Характерные свойства каустической соды
Каустическая сода – это распространенная и самая сильная щелочь. Она имеет вид чешуйчатых гранул белого цвета без ярко выраженного запаха. Размер чешуек колеблется от 0,2 до 0,5 мм. Вещество обладает прекрасными гигроскопическими свойствами, а также замечательно растворяется в воде. При растворении выделяет тепло.
Сода каустическая также известна, как технический едкий натрий и каустик. Ее выпускают в жидком и твердом виде. Вещество предназначается для химической, металлургической, автомобильной, пищевой (Е 524), легкой, газовой и нефтяной промышленности. Каустик занял достойное место и в медицине. Такую соду используют для изготовления минерального удобрения, биотоплива и в целлюлозно-бумажной отрасли.
https://www.youtube.com/watch?v=u2Un0-NrFdQ
Хотя вещество и применяется во многих сферах деятельности, оно имеет некоторые неприятные особенности. К недостаткам каустической соды можно отнести:
- вещество небезопасное, работая с ним нужно использовать перчатки и очки;
- надо быть внимательными, так как вещество медленно разъедает эмалированное покрытие ванной и раковины.
Однако, сода имеет много положительных сторон, к которым относится:
- средство 100% разъедает все жировые и органические отложения;
- действует даже после промывания канализации;
- сглаживает шероховатости внутри труб, что тормозит процесс отложения;
- для профилактики достаточно использовать один раз в месяц;
- сода имеет невысокую цену и доступна во всех магазинах.
Каустическая сода или едкий натр чаще всего представляет собой порошок в виде мельчайших кристаллов или твердых гранул белого цвета без запаха. Из-за высокой гигроскопичности на воздухе они быстро расплываются, впитывая влагу. Вещество превосходно растворяется в H2O, образуя мылкую на ощупь жидкость и выделяя при этом большое количество теплоты: в 100 г при температуре 20 градусов Цельсия растворяется 46 г соды.
Химические свойства
Твердое вещество имеет температуру плавления чуть больше 65 градусов по Цельсию. При растворении молекулы химического соединения переходят в гидратированную форму с более низкой температурой плавления – 15,5 градусов. Едкий натр хорошо растворяется в метиловом и этиловом спиртах.
Само название – Caustic Soda или едкий натр, свидетельствует об агрессивной природе этого вещества. Природная сода была знакома еще древним египтянам и грекам, которые использовали ее при изготовлении красок, бальзамировании, отбеливании холстов.
Водные растворы каустической соды имеет сильную щелочную реакцию – рН 1%-ного раствора равен 13. Их хранение и перевозка требует особых условий безопасности – специальных стальных контейнеров. Поэтому чаще всего гидроксид натрия выпускается в твердом виде и перевозится в герметичных мешках.
Этимология
Слово «щелочи» происходит от арабского аль qalīy (или щелочи ), а это означает прокаленного золы (см прокаливание ), ссылаясь на оригинальный источник щелочных веществ. Водный экстракт сожженной золы растений, называемый калием, состоящий в основном из карбоната калия, был умеренно основным. После нагревания этого вещества с гидроксидом кальция ( гашеной известью ) было получено гораздо более сильное основное вещество, известное как едкий калий ( гидроксид калия ). Едкий калий традиционно использовался в сочетании с животными жирами для производства мягкого мыла — одного из каустических процессов, при котором мыло превращалось в жир в процессе омыления , известном с древних времен. Растительный калий дал название элементу калию , который впервые был получен из едкого калия, а также дал калию его химический символ K (от немецкого названия Kalium), который в конечном итоге произошел от al k ali.
Взаимодействие с индикаторами
Для определения pH исследуемого раствора используются специальные химические вещества — индикаторы, которые меняют свой цвет в зависимости от значения показателя водорода в среде. Самый распространенный индикатор, используемый в химических исследованиях, — лакмус. В щелочной среде он приобретет интенсивный синий цвет.
Другой доступный индикатор, фенолфталеин, в щелочной среде приобретает малиновый окрас. Однако в очень концентрированном растворе (показатель водорода близок к 14) фенолфталеин остается бесцветным, как и в нейтральной среде. Потому лакмус при работе с концентрированными щелочами использовать предпочтительнее.

Метиловый оранжевый индикатор в щелочной среде приобретает желтый окрас, при уменьшении pH среды цвет меняется от желтого до оранжевого и красного.
Использование в домашнем хозяйстве
Несмотря на второй класс опасности, едкий натр можно применять в хозяйстве (при соблюдении соответствующих мер безопасности).
Чистка труб
Применение каустической соды для чистки канализации даёт очень хороший результат. Щёлочь поможет не только справиться с засором, но и удалить неприятные запахи в туалете и ванной комнате. Методы применения следующие:
- Половину стакана каустика засыпать в сливное отверстие, сверху аккуратно залить стакан кипятка и выдержать не менее двух часов. По истечении указанного времени промыть стоки большим количеством воды.
- Двести граммов соды засыпать в отверстие, добавить столько же белого уксуса, выдержать три часа, тщательно промыть кипятком. Этот метод промывки используется при сильных застарелых засорах.
- В ведро кипятка насыпать два килограмма каустика, перемешать, влить гидроксид натрия и воду непосредственно в отверстие слива. Через три часа прочистить трубы водой.
Важно: не следует насыпать соду непосредственно на эмалированную поверхность ванны, так эмаль может повредиться
Использование при стирке
Сода может применяться при стирке, она хорошо смягчает воду и удаляет различные пятна. Используют раствор едкого натра только для стирки льняных и хлопчатобумажных вещей, стирка шёлка, шерсти и других тканей, требующих бережного отношения, не рекомендуется. Для приготовления раствора в пятилитровой ёмкости нужно развести пять столовых ложек соды, перемешать. Сухое бельё опускается в раствор, выдерживается в течение двух часов, после чего стирается порошком или мылом. При стирке в машинке две ложки средства добавляются в отсек для стирального порошка.
Важно: после использования каустической соды вещи необходимо тщательно прополоскать. Сода может применяться при стирке, она хорошо смягчает воду и удаляет различные пятна
Используют раствор едкого натра только для стирки льняных и хлопчатобумажных вещей, стирка шёлка, шерсти и других тканей, требующих бережного отношения, не рекомендуется. Для приготовления раствора в пятилитровой ёмкости нужно развести пять столовых ложек соды, перемешать. Сухое бельё опускается в раствор, выдерживается в течение двух часов, после чего стирается порошком или мылом. При стирке в машинке две ложки средства добавляются в отсек для стирального порошка
Сода может применяться при стирке, она хорошо смягчает воду и удаляет различные пятна. Используют раствор едкого натра только для стирки льняных и хлопчатобумажных вещей, стирка шёлка, шерсти и других тканей, требующих бережного отношения, не рекомендуется. Для приготовления раствора в пятилитровой ёмкости нужно развести пять столовых ложек соды, перемешать. Сухое бельё опускается в раствор, выдерживается в течение двух часов, после чего стирается порошком или мылом. При стирке в машинке две ложки средства добавляются в отсек для стирального порошка.
Важно: после использования каустической соды вещи необходимо тщательно прополоскать
Чистка кухонной утвари
Нагар и застаревший жир со стальной и чугунной посуды можно удалить с помощью щёлочи. Понадобятся следующие ингредиенты:
- Сода — 200 г.
- Вода — 10 литров.
- Клей силикатный или жидкое стекло — 150 мл.
- Мыло хозяйственное — один брусок.
Приготовление раствора: в ёмкость налить воду, добавить натр, клей или жидкое стекло, натёртое стиральное мыло, всё тщательно перемешать. Посуда опускается в моющий раствор, ёмкость ставится на огонь и кипятится на малом огне в течение двух часов, после чего нужно дождаться полного остывания. Очищенную посуду хорошо промыть под струёй проточной воды.
Важно: алюминий и тефлон мыть едким натром нельзя, для такой посуды используется кальцинированная соль. Разница между ними в том, что кальцинированная соль гораздо менее активна и не повредит посуде
Нагар и застаревший жир со стальной и чугунной посуды можно удалить с помощью щёлочи. Понадобятся следующие ингредиенты:
- Сода — 200 г.
- Вода — 10 литров.
- Клей силикатный или жидкое стекло — 150 мл.
- Мыло хозяйственное — один брусок.
Приготовление раствора: в ёмкость налить воду, добавить натр, клей или жидкое стекло, натёртое стиральное мыло, всё тщательно перемешать. Посуда опускается в моющий раствор, ёмкость ставится на огонь и кипятится на малом огне в течение двух часов, после чего нужно дождаться полного остывания. Очищенную посуду хорошо промыть под струёй проточной воды.
Важно: алюминий и тефлон мыть едким натром нельзя, для такой посуды используется кальцинированная соль. Разница между ними в том, что кальцинированная соль гораздо менее активна и не повредит посуде
Химические свойства оснований
1. Щелочи (растворимые основания) из металлов реагируют только с Zn, Be и Al:
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2
Be + 2NaOH + 2H2O → Na2[Be(OH)4] + H2
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2
Cr + NaOH → реакция не идет
Fe + NaOH → реакция не идет
2. Щелочи из неметаллов реагируют только с S, P, Si и галогенами:
3S + 6NaOH → Na2SO3 + 2Na2S + 3H2O
P4 + 3NaOH + 3H2O → PH3 + 3NaH2PO2 (t°, гипофосфит натрия)
Si + 2NaOH + H2O → Na2SiO3 + 2H2
Cl2 + 2NaOH → NaCl + NaClO + H2O (аналогично для Br2, I2)
3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O (при нагревании, аналогично для Br2, I2).
2F2 + 2NaOH → OF2 + 2NaF + H2O (продукты этой реакции на ЕГЭ не проверяются, но необходимо знать, что реакция протекает)
3. Основания взаимодействуют с кислотами с образованием средних, кислых или основных солей. Тип соли зависит от соотношения реагентов: например, в избытке кислоты образуются кислые соли.Условие: один из реагентов должен быть растворимым.
H2SO4 + 2KOH → K2SO4 + 2H2O (соотношение реагентов 1:2)
H2SO4 + KOH → KHSO4 + H2O (соотношение реагентов 1:1)
HCl + Cu(OH)2 → CuOHCl + H2O или
2HCl + Cu(OH)2 → CuCl2 + 2H2O
H2SiO3 + Cu(OH)2 → реакция не идет, так как и H2SiO3 и Cu(OH)2 нерастворимые.
4. Основания взаимодействуют с солями
Условие: 1) оба реагента должны быть растворимыми; 2) должен выпадать осадок или выделяться газ.
2NaOH + ZnCl2 → Zn(OH)2 + 2NaCl
NaOH + NH4NO3 → NH3 + NaNO3 + H2O
Cu(OH)2 + NaNO3 → реакция не идет, так как гидроксид меди (II) нерастворим.
5. Основания реагируют с кислотными оксидами. Если оксид в избытке образуется кислая соль:
Ca(OH)2 + CO2 → CaCO3 + H2O
Ca(OH)2 + 2CO2 → Ca(HCO3)2
6. Щелочи реагируют с амфотерными оксидами:
1) реакции в растворе:
ZnO + 2NaOH + H2O → Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)
BeO + 2NaOH + H2O → Na2[Be(OH)4] (тетрагидроксобериллат натрия)
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4] (тетрагидроксоалюминат натрия)
2) реакции при сплавлении:
ZnO + 2NaOH → Na2ZnO2 + H2O (цинкат натрия)
BeO + 2NaOH → Na2BeO2 + H2O (бериллат натрия)
Al2O3 + 2NaOH → 2NaAlO2 + H2O (метаалюминат натрия)
7. Щелочи реагируют с амфотерными гидроксидами:
1) реакции в растворе:
Zn(OH)2 + NaOH → Na2[Zn(OH)4]
Be(OH)2 + NaOH → Na2[Be(OH)4]
Al(OH)3 + NaOH → Na[Al(OH)4]
2) реакции при сплавлении:
Zn(OH)2 + 2NaOH → Na2ZnO2 + 2H2O (кислота: H2ZnO2)
Be(OH)2 + 2NaOH → Na2BeO2 + 2H2O (кислота: H2BeO2)
Al(OH)3 + NaOH → NaAlO2 + 2H2O (кислота: HAlO2)
8. Нерастворимые основания (а также Ca(OH)2 и LiOH) разлагаются при нагревании:
Ca(OH)2 → CaO + H2O
2LiOH → Li2O + H2O
Mg(OH)2 → MgO + H2O
Fe(OH)2 → FeO + H2O
Cu(OH)2 → CuO + H2O.
Концентрированные кислоты и щелочи
Ядовитые жидкости находятся не только в школьных лабораториях, они и вокруг нас. Это различные средства бытовой химии (стиральные порошки и пятновыводители), цветочные удобрения и ядохимикаты, лаки и краски, клеи и растворители, бензин и дизельное топливо, аккумуляторные, тормозные и прочие технические жидкости, а на кухне — уксус и уксусная кислота.
Совершенно очевидно, что все вышеупомянутые вещества должны использоваться строго по назначению и в соответствии с определенными правилами, указанными на этикетке каждого средства. К сожалению, несоблюдение мер безопасности при работе с ядовитыми средствами может привести к серьезным проблемам со здоровьем: отравлению, различным повреждениям кожи и слизистых оболочек.
Продукты, которых следует избегать
| Мясо | Сильное окисляющее воздействие |
| Рыба | Сильное окисляющее воздействие |
| Сало | Среднее окисляющее воздействие |
| Яйца | Сильное окисляющее воздействие |
| Морепродукты (устрицы, ракообразные, мидии, креветки, др.) | Сильное окисляющее воздействие |
| Твёрдый сыр | Среднее окисляющее воздействие |
| Мягкий сыр | Слабое окисляющее воздействие |
| Сметана, сливки, сливочное масло | Среднее окисляющее воздействие |
| Мёд магазинный или несвежий | Среднее окисляющее воздействие |
| Пастеризованное молоко | Среднее окисляющее воздействие |
| Алкоголь | Сильное окисляющее воздействие |
| Кофе | Сильное окисляющее воздействие |
| Какао | Среднее окисляющее воздействие |
| Чёрный чай | Среднее окисляющее воздействие |
| Рафинированный сахар и сладости, его содержащие | Сильное окисляющее воздействие |
| Магазинные соки (чаще всего содержат консерванты и сахар) | Сильное окисляющее воздействие |
| Крупы (за исключением гречки и проса) | Среднее/слабое окисляющее воздействие |
| Дрожжевые мучные изделия | Среднее окисляющее воздействие |
| Арахис | Сильное окисляющее воздействие |
| Грецкий орех | Сильное окисляющее воздействие |
| Кешью | Среднее окисляющее воздействие |
| Семечки, подсолнечное масло | Слабое окисляющее воздействие |
| Овощи тушёные, варёные | Среднее/слабое окисляющее воздействие |
| Овощи жареные | Сильное окисляющее воздействие |
| Варенье | Сильное окисляющее воздействие |
| Фрукты неспелые | Среднее окисляющее воздействие |
| Бобовые сушёные (горох, нут, чечевица, фасоль, др.) | Среднее окисляющее воздействие |
Существует много спорной информации относительно того, какой продукт закисляет, а какой ощелачивает. Более-менее единое мнение есть только относительно мясной пищи, яиц, рыбы, алкоголя, кофе, сахара и рафинированных продуктов. Включая в рацион этот список, вы понижаете уровень Ph своего организма. Да и о вреде этих продуктов, помимо влияния на кислотно-щелочной баланс, достаточно много другой информации.
Список продуктов с самым высоким показателем pH.
Существует множество щелочных продуктов, но все они обладают разным уровнем pH. Самыми высокими показателями обладают:
- Лимон.
- Зелень.
- Корнеплоды.
- Капуста.
- Брокколи.
- Авокадо.
- Огурец.
- Сельдерей.
- Пророщенная пшеница.
- Морская капуста.
- Травяной чай.
Лимон для здоровья и похудения.
Немного исторических моментов из истории получения щелочи.
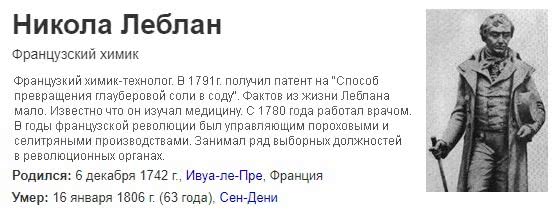
Люди на протяжении столетий используют щелочь, получая ее сначала от выщелачивания (водных растворов) некоторых пустынных земель. До конца 18 века выщелачивание из древесной золы или морской водоросли было основным источником получения щелочей. В 1775 году Французская Академия наук предложила денежные призы за новые методы производства щелочей. Премия за кальцинированную соду была присуждена французу Николасу Леблану , который в 1791 году запатентовал процесс превращения хлорида натрия в карбонат натрия.
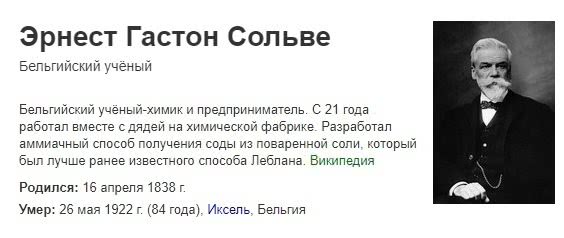
Лебланский способ производства доминировал в мировом производстве до конца 19-го века, но после первой мировой войны был полностью вытеснен другим методом конверсии соли, который был усовершенствован в 1860-х годах Эрнестом Солве из Бельгии. В конце XIX века появились электролитические методы производства каустической соды, объемы которых быстро росли.
По методу Солве, аммиачно-содовый процесс производства кальцинированной соды протекал следующим образом: поваренная соль в виде сильного рассола химически обрабатывалась для устранения примесей кальция и магния и затем насыщалась рециркулирующим газом аммиака в башнях. После, аммиачный рассол насыщался газом с использованием газообразного диоксида углерода при умеренном давлении в башне другого типа. Эти два процесса дают бикарбонат аммония и хлорид натрия, двойное разложение которого дает желаемый бикарбонат натрия, а также хлорид аммония. Затем бикарбонат натрия нагревают до разложения его до необходимого карбоната натрия. Аммиак, вовлеченный в процесс, почти полностью восстанавливается путем обработки хлоридом аммония с известью, с получением аммиака и хлорида кальция. Восстановленный аммиак затем повторно используют в описанных выше процессах.
Электролитическое производство каустиеской соды включает электролиз сильного солевого раствора в электролитической ячейке . (Электролиз — это разрушение соединения в растворе в его составляющие с помощью электрического тока для того, чтобы вызвать химическое изменение.) Электролиз хлорида натрия дает хлор, гидроксид натрия, либо металлический натрий. Гидроксид натрия в некоторых случаях конкурирует с карбонатом натрия в одних и тех же процессах применений. И в любом случае оба являются взаимопревращаемыми с помощью довольно не сложных процессов. Хлорид натрия может быть
превращен в щелочь одним из двух процессов, причем разница между ними заключается лишь в том, что процесс аммиачно-содовой реакции дает хлор в виде хлорида кальция, соединения с небольшим экономическим значением, тогда как электролитические процессы производят элементарный хлор , который имеет бесчисленное применение в химической промышленности.
В нескольких местах в мире существуют значительные запасы минеральной формы кальцинированной соды, известной как природная щелочь. На таких месторождениях производят большую часть природной щелочи в мире из обширных месторождений в подземных шахтах.

Природный натрий металлический.
Прочитайте статью Щелочи (источник «Энциклопедический словарь химика»)и получите больше представления о том что такое щелочь, или посмотрите видеоролик об этом химическом реактиве Щелочи.
Правила безопасности
Гидроксид натрия является мощной щелочью, способной разъесть даже твердые материалы
Для сохранения вашего здоровья и целостности поверхностей обязательно нужно соблюдать меры предосторожности
- Наденьте средства защиты. Прежде чем начинать процедуры, вооружитесь очками и маской, резиновые перчатки должны доходить до локтя, одежда должна быть плотная и не оставляющая открытых участков тела. Этим вы убережете себя от химических ожогов.
- Дождитесь окончания реакции. Так как каустик, взаимодействуя с водой, способен к выделению тепла, не стоит сразу начинать выполнять с ним процедуры. Подождите несколько минут до полного окончания химических реакций.
- Не разбрызгивайте средство. Поверхности, особенно эмалированные, от этого могут пострадать.
- Избегайте контакта с кожей. При попадании средства на открытые участки тела, или в глаза незамедлительно промойте их под проточной водой. Затем обработайте 2%-ной борной кислотой. Если через полчаса жжение, покраснение так и не пройдут — обратитесь за медицинской помощью.
- Правильно храните. Каустик нужно хранить в хорошо закрытой железной или стеклянной банке. Он не должен находиться в свободном доступе, так как ядовит и взрывоопасен.
Помните, что частое использование каустика может привести к разрушению поверхности даже самых прочных материалов.
Применение гидроксида натрия
Нет более распространенной щелочи, чем каустическая сода. Ежегодно потребляется порядка 57 млн т. Едкий натрий используется при получении лекарственных препаратов, фенола, органических красителей, глицерина. Еще одна сфера применения – дезинфекция помещения из-за способности химического соединения нейтрализовать вредные для человека вещества, находящиеся в воздухе. Еще гидроокиси широко используются для поддержания формы продуктов (пищевая промышленность).

В промышленности
Гидроокись натрия относится к сильной основе для химических реакций и активно применяется разными отраслями благодаря своим свойствам:
- Целлюлозной отраслью – для устранения сульфата в составе древесных волокон для размягчения (делигнификация). Это нужно при производстве картона, бумаги, искусственных волокон.
- Химической промышленностью – применяется для производства масел, нейтрализации веществ кислотной среды, при травлении алюминия, изготовлении чистых металлов.
- Гидроокись натрия используется для получения биодизельного топлива на основе растительных масел, в результате реакции образуется глицерин.
- Соединением омывают пресс-формы автомобильных покрышек.
- В гражданской обороне он распространен при нейтрализации опасных для здоровья веществ в воздухе, дегазации.
- Применяется средство для нелегального производства наркотиков типа метамфетаминов.
Пищевая добавка
Каустическая сода очищает овощи, фрукты от кожицы. Применяется вещество для придания цвета карамели. Как пищевая добавка E524 (класс регуляторов кислотности, веществ против комкования наряду с карбонатом натрия) используется при изготовлении какао, мороженого, сливочного масла, маргарина, шоколада, безалкогольных напитков. Оливки и маслины размягчаются, приобретают черный цвет.
Пищевые продукты – рогалики и немецкие крендели (брецели) – обрабатывают едким раствором для хрустящей корочки. В скандинавской кухне существует рыбное блюдо – лютефиск. Технология приготовления включает вымачивание на протяжении 5-6 суток сушеной трески в растворе гидроокиси, пока не будет получена желеобразная консистенция. В пищевой промышленности сода помогает рафинировать растительное масло.
В производстве моющих средств
Способность взаимодействия жиров у каустика была замечена уже давно. С VII века арабы освоили получение твердого мыла с помощью едкого натра и ароматических масел. Эта технология осталась прежней. Каустическая сода добавляется в шампуни, моющие вещества, средства личной гигиены. Косметическая промышленность применяет гидроксид Na для получения мыла против жиров, жидкости для снятия лака, кремов.
В быту
Основной способ применения – гелеобразный гидроксид или его гранулы. Входит в состав средств для устранения засоров канализации, систем отопления. Грязь растворяется, дезагрегируется и проходит дальше по трубе. Изделия из нержавеющей стали очищаются от масляных веществ с помощью каустической соды, разогретой до 50-60°С с добавлением гидроксида калия. Косметология применяет гель на его основе для размягчения ороговевшей кожи, папиллом, бородавок.

https://youtube.com/watch?v=Dy8cJNO924I
https://youtube.com/watch?v=8ghScOszH7I
Что делать, если сода и уксус не помогают
Если домашние средства не помогают справиться с засором, можно прибегнуть к использованию таких специализированных инструментов и составов:
- Покупные препараты в виде растворов, порошковых смесей и гелей. Такие средства обладают высоким уровнем эффективности. Они отличаются составом и назначением. При покупке препарата нужно внимательно ознакомиться с инструкцией по применению и информацией, которая указана на упаковке.
- Канализационный трос. Это приспособление выполнено в виде длинного шнура с заостренным или спиралеобразным наконечником. Таким инструментом можно ликвидировать любые заторы.
- Вантуз. Это самое простое приспособление для механической прочистки канализационной системы. В большинстве случаев она представляет собой полусферу из резины с деревянной или пластиковой рукоятью для удобной эксплуатации.
Пользоваться покупными и домашними средствами для удаления заторов в трубопроводе нужно, соблюдая правила безопасности и технологию обработки.
Щёлочи
Щёлочи — гидроксиды щелочных, щёлочноземельных металлов и некоторых других элементов, например, таллия.
К щелочам относятся хорошо растворимые в воде основания.
При диссоциации щёлочи образуют анионы OH− и катион металла.
К щелочам относятся гидроксиды металлов подгрупп Iа и IIа (начиная с кальция) периодической системы, например NaOH (едкий натр), KOH (едкий калий), Ba(OH)2 (едкий барий).
В качестве исключения можно отнести к щелочам гидроксид одновалентного таллия TlOH, который хорошо растворим в воде и является сильным основанием.
Едкие щёлочи — тривиальное название гидроксидов лития LiOH, натрия NaOH, калия КОН, рубидия RbOH и цезия CsOH. Название «едкая щёлочь» обусловлено свойством разъедать кожу и слизистые оболочки, вызывая сильные ожоги, бумагу и другие органические вещества.
Из-за очень большой химической активности щёлочных металлов едкие щёлочи долгое время не удавалось разложить и они потому считались простыми веществами.
Физические свойства Щелочи:Гидроксиды щелочных металлов (едкие щёлочи) представляют собой твёрдые, белые, очень гигроскопичные вещества. Щёлочи — сильные основания, очень хорошо растворимые в воде, причём реакция сопровождается значительным тепловыделением.
Сила основания и растворимость в воде возрастает с увеличением радиуса катиона в каждой группе периодической системы. Самые сильные щёлочи — гидроксид цезия (поскольку из-за очень малого периода полураспада гидроксид франция не получен в макроскопических количествах) в группе Ia и гидроксид радия в группе IIa. Кроме того, едкие щёлочи растворимы в этаноле и метаноле.
Химические свойства Щелочи:Щёлочи проявляют основные свойства.
В твёрдом состоянии все щёлочи поглощают H2O из воздуха, а также CO2 (также и в состоянии раствора) из воздуха, постепенно превращаясь в карбонаты.
Щёлочи, как основания, взаимодействуют с кислотами с образованием соли и воды (реакция нейтрализации).
Это одно из самых важных химических свойств щелочей.
Щёлочь + Кислота → Соль + Вода
Щёлочи взаимодействуют с кислотными оксидами с образованием соли и воды:
Щёлочь + Кислотный оксид → Соль + Вода
Щёлочи широко применяются в различных производствах и медицине; также для дезинфекции прудов в рыбоводстве и как удобрение, в качестве электролита для щелочных аккумуляторов.
Водные растворы щелочей изменяют окраску индикаторов.
Метиловый фиолетовый — ЗелёныйКрезоловый красный — ЖёлтыйМетиловый фиолетовый — СинийТимоловый синий — ЖёлтыйТропеолин — ЖёлтыйМетиловый фиолетовый — Фиолетовый(Ди)метиловый жёлтый — ЖёлтыйБромфеноловый синий — Сине-фиолетовыйКонго красный — СинийМетиловый оранжевый — Оранжево — жёлтыйБромкрезоловый зелёный — СинийБромкрезоловый синий — СинийЛакмоид — СинийМетиловый красный — ЖёлтыйХлорфеноловый красный — КрасныйЛакмус (азолитмин) — СинийБромкрезоловый пурпурный — Ярко-красныйБромтимоловый синий — СинийНейтральный красный — Янтарно-жёлтыйФеноловый красный — Ярко-красныйКрезоловый красный — Тёмно-красныйα-Нафтолфталеин — СинийТимоловый синий — СинийФенолфталеин — Малиново-красныйТимолфталеин — СинийАлизариновый жёлтый — Коричнево-жёлтыйНильский голубой — КрасныйДиазофиолетовый — ФиолетовыйИндигокармин — ЖёлтыйEpsilon Blue — Тёмно-фиолетовый
Хромовый Тёмно синий — Синий






