Получение солей
Для получения солей используют реакции, с которыми вы познакомились при изучении химических свойств оксидов, кислот, оснований и солей.
Схемы этих реакций и их примеры приведены в предыдущих уроках на нашем сайте. Номера схем и соответствующие им классы исходных веществ для получения солей указаны в таблице.
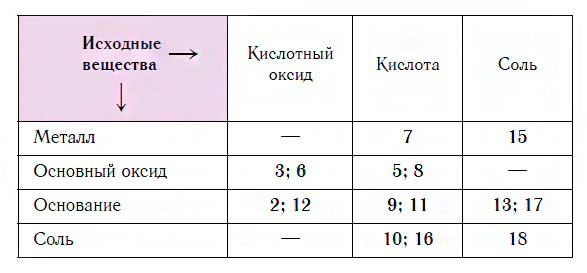
Очевидно, что одну и ту же соль можно получить несколькими способами, исходя из разных веществ. Покажем, как пользоваться этой таблицей, на примерах.
Пример 1. Из таблицы видно, что в строке «Основный оксид» находятся цифры 3, 6, 5, 8. Из них цифры 3 и 6 попадают в столбец «Кислотный оксид», а цифры 5 и 8 — в столбец «Кислота». Это значит, что соль можно получить по реакции основного оксида с кислотным оксидом (по схемам 3 или 6), а также с кислотой (по схемам 5 или 8).
Пример 2. Какие вещества реагируют с кислотами с образованием солей? Из таблицы видно, что в столбце «Кислота» находятся числа 7, 5, 8, 9, 11, 10 и 16. Из них число 7 попадает в строку «Металл»; числа 5 и 8 — в строку «Основный оксид»; числа 9 и 11 — в строку «Основание», а числа 10 и 16 — в строку «Соль». Это значит, что соли образуются в результате взаимодействия кислот с металлами (по схеме 7), с основными оксидами (по схемам 5 или 8), с основаниями (по схемам 9 или 11), а также с солями (по схемам 10 или 16).
Физические свойства
Как бы ни был широк класс этих веществ, но общие физические свойства солей выделить возможно. Это вещества немолекулярного строения, с ионной кристаллической решеткой.

Очень высокие точки плавления и кипения. При нормальных условиях все соли не проводят электричество, но в растворе большинство из них прекрасно проводит ток.
Цвет может быть самым разным, он зависит от иона металла, входящего в ее состав. Сульфат железа (FeSO4) — зеленый, хлорид железа (FeCl3) — темно-красный, а хромат калия (K2CrO4) красивого ярко-желтого цвета. Но большинство солей все-таки бесцветные или белые.

Растворимость в воде также бывает различной и зависит от состава ионов. В принципе, все физические свойства солей имеют особенность. Они зависят от того, ион какого металла и какой кислотный остаток включены в состав. Продолжим рассматривать соли.
Химия
СЭМ изображение крупинки поваренной соли
Соль — это в основном хлорид натрия (NaCl). Морская соль и добытая соль могут содержать микроэлементы . Добытая соль часто очищается. Кристаллы соли полупрозрачные, кубической формы; они обычно кажутся белыми, но примеси могут придавать им синий или фиолетовый оттенок. При растворении в воде хлорид натрия разделяется на ионы Na + и Cl — , а растворимость составляет 359 граммов на литр. Из холодных растворов соль кристаллизуется в виде дигидрата NaCl · 2H 2 O. Растворы хлорида натрия имеют свойства, сильно отличающиеся от свойств чистой воды; точка замерзания составляет -21,12 ° С (-6,02 ° F) в течение 23,31 мас% соли, а температура кипения насыщенного солевого раствора составляет около 108,7 ° С (227,7 ° F).
Состав солей
К солям относятся сложные вещества, в состав которых входят атомы металлов и кислотные остатки.
Общая формула солей — MexАy, где Ме — символ какого-либо металла, А — кислотный остаток. Поскольку разных металлов и кислотных остатков известно много, число образованных ими солей огромно — несколько тысяч. А знакомая нам поваренная соль NaCl — только одно вещество из огромного класса солей. Но не следует думать, что все они соленые на вкус, окрашены в белый цвет и растворимы в воде.
Подавляющее большинство солей обладают совсем другим вкусом. К тому же многие соли ядовиты. Соли могут быть окрашены в разные цвета. Известны соли, которые, в отличие от поваренной, нерастворимы в воде.
Теперь вы не удивитесь тому, что к солям относятся, например, мел, которым вы пишите на доске, или марганцовка из домашней аптечки.
Ученые предполагают, что слово «соль» происходит от слова «Солнце». Дело в том, что под воздействием теплых солнечных лучей вода некоторых озер постепенно испаряется, оставляя на дне твердое белое вещество. Оно пришлось по вкусу древним людям и прочно вошло в нашу жизнь под названием «соль». Позже это слово стали использовать во множественном числе для обозначения целого класса однотипных веществ, которые вы сейчас изучаете.
Цвет соли
Розовая соль
Самый красивый оттенок кристаллам соли придают примеси железа. В розовой соли насчитывают все 84 основных микроэлемента, необходимых нашему телу — медь, калий, кальций, магний и прочие.
Впрочем, бывают разные варианты. Садочной розовой соли из Крыма цвет придают местные микроводоросли. Розово-коричневый цвет кристаллам соли с Гавайев придают включения глины. Секрет цвета розовой австралийской соли — богатые каротином морские растения.
У розовой соли минеральный, железистый привкус. Эту соль особо рекомендуют подавать к мясу, но это вопрос исключительно вкуса.
Серая соль
Кельтской соли, которую добывают во Франции, серый цвет придает глина. Собирают ее по традиции вручную, когда на солончаке образуется корка, и добыча зависит от погоды, поэтому стоит она дороже обычной. В кельтской соли содержится более 80 минеральных элементов, потому что многоступенчатую очистку она не проходит.
В серой соли есть йод и меньше натрия, чем в обычной соли. Повара любят использовать ее при подаче лосося.
Синяя соль
Очень редкий вид соли — ее необычный цвет связан с минералом сильвинитом. Обычно он желтый или розовый, но иногда бывает и синим: единственное место добычи необычной соли — соляные шахты Ирана с древней историей.
В каменной синей соли много калия и хлора. Ее вкус описывают, как «пряный», а подавать советуют с такими дорогими блюдами, как трюфели и фуа-гра.
https://youtube.com/watch?v=NoJwmTojdWk
Видео о том, как делают самую дорогую соль в мире
Черная соль
Гималайской соли сульфит железа придает необычный черно-фиолетовый цвет. Из-за сернистых соединений она еще и пахнет необычно, сероводородом.
Другие типы черной соли цветом обязаны, как правило, включением угля или даже частиц лавы, как Гавайская Лавовая соль.
Черный цвет соли может быть связан не с происхождением, а с обработкой минерала. Например, так делается четверговая соль. Обычную пищевую соль в Великий четверг перед Пасхой перемешивают с размоченным ржаным хлебом. Потом нагревают на сковороде, в печи или духовке. Готовый ком разбивают.
Считается, что после обжига черная соль теряет часть вредных веществ и становится более полезной и насыщенной. Вкус у нее слегка сероводородный, ее можно даже использовать в вегетарианских блюдах, чтобы придать им вкус яиц.
Бланшированные аргентинские креветки с диким рисом и чатни из ананаса, манго и папайи в программе питания для снижения веса Solo Slim
Химические свойства кислых солей
Отношение кислых солей к щелочам и кислотам
Кислые соли реагируют с щелочами. При этом, если щелочь содержит тот же металл, что и кислая соль, то образуются средние соли:
Также, если в кислотном остатке кислой соли осталось два или более подвижных атомов водорода, как, например, в дигидрофосфате натрия, то возможно образование как средней:
так и другой кислой соли с меньшим числом атомов водорода в кислотном остатке:
Важно отметить, что кислые соли реагируют с любыми щелочами, в том числе и теми, которые образованы другим металлом. Например:. Кислые соли, образованные слабыми кислотами, реагируют с сильными кислотами аналогично соответствующим средним солям:
Кислые соли, образованные слабыми кислотами, реагируют с сильными кислотами аналогично соответствующим средним солям:
Термическое разложение кислых солей
Все кислые соли при нагревании разлагаются. В рамках программы ЕГЭ по химии из реакций разложения кислых солей следует усвоить, как разлагаются гидрокарбонаты. Гидрокарбонаты металлов разлагаются уже при температуре более 60 оС. При этом образуются карбонат металла, углекислый газ и вода:
Последние две реакции являются основной причиной образования накипи на поверхности водонагревательных элементов в электрических чайниках, стиральных машинах и т.д.
Гидрокарбонат аммония разлагается без твердого остатка с образованием двух газов и паров воды:
27.373. Химические свойства солей
Физические свойства солей
По растворимости в воде соли делятся на растворимые в воде, малорастворимые и нерастворимые. Растворимость большинства солей вы можете посмотреть в таблице растворимости.
Химические свойства солей
1. Соли взаимодействуют с металлами с образованием новой соли и нового металла. Данный металл может вытеснять из растворов солей только те металлы, которые находятся правее его в электрохимическом ряду напряжений.
Ме1 + соль1 = Ме2 + соль2
Fe + CuSO4 = FeSO4 + Cu
2. Растворы солей взаимодействую со щелочами с образованием новой соли и нового основания. Реакция возможна, если в результате реакции будет выпадать осадок или выделяться газ (NH3 + H2O)
Раствор соли + Раствор щелочи = Новая соль + Новое основание
CuSO4+ 2NaOH = Cu(OH)2↓ + Na2SO4
FeCl3 + 3KOH = Fe(OH)3 ↓ + 3KCl
MgCl2 + 2NaOH = 2NaCl + Mg(OH)2 ↓
$NH_4OH = NH_3 \cdot H_2O$
3. Соли взаимодействуют с кислотами с образованием новой более слабой кислоты или новой нерастворимой соли.
Соль + кислота = новая соль + новая кислота
BaCl2 + H2SO4 = BaSO4↓ + 2HCl
Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3↓
При взаимодействии соли с кислотой, образующей данную соль, получается кислая соль (если кислота многоосновная): Na2S + H2S= 2 NaHS
Основные соли при действии кислот переходят в средние.
FeOHCl +HCl → FeCl2 + H2O
4. Растворы солей могут взаимодействовать между собой с образованием солей, если одна из солей выпадет в осадок
Соль1 + соль2 = соль3 + соль4
AgNO3 + NaCl = AgCl↓ + NaNO3
BaS + K2SO4 = BaSO4↓ + K2S
5. Кислые соли взаимодействуют с растворимыми основаниями с образованием средний солей и воды.
Кислая соль + щелочь = средняя соль + H2O
NaHSO3 + NaOH = Na2SO3 + H2O
NaHS + NaOH = Na2S + H2O
6. Электролиз (подробнее вы можете прочитать в теории – электролиз).
Разложение различных солей (всегда при температуре)
Разложение карбонатов (2х, 3х валентных металлов, кроме щелочных металлов)
CaCO3 = CaO + CO2
MgCO3 = MgO + CO2
Разложение гидрокарбонатов
2NaHCO3 = Na2CO3 + CO2 + H2O
Ca(HCO3)2 = CaO + 2CO2 + H2O
$Mg(HCO_3) = Mg(OH)_2 + 2CO_2$
Разложение гидроксокарбонатов
(CuOH)2CO3 = 2CuO + CO2 + H2O
$$\text{Разложение солей аммония}$$ $NH_4Cl = NH_3 + HCl \\ (NH_4)_2SO_4 = NH_3 + NH_4HSO_4 \\ (NH_4)_2CO_3 = 2NH_3 + CO_2 + H_2O$
Разложение нитратов
|
Металлы, которыми образованы соли |
Продукты разложения |
Пример |
|
До Mg (Li) |
MeNO2 + O 2 |
2KNO3 = 2KNO2 + O2 |
|
От Mg по Cu (+ Li) |
MeO + NO2 + O2 |
2Zn(NO3)2 = 2ZnO + 4NO2 + O2 |
|
После Cu |
Me + NO2 + O2 |
2AgNO3 = 2Ag + 2NO2 + O |
$$\text{ЗАПОМНИТЕ}$$ $4Fe(NO_3)_2 = 2Fe_2O_3 + 8NO_2 + O_2 \\ NH_4NO_2 = N_2 + 2H_2O \\ NH_4NO_3 = N_2O + 2H_2O$
$$\text{ДРУГИЕ СОЛИ}$$ $2KMnO_4 = K_2MnO_4 + MnO_2 + O_2 \\ 2KClO_3 = 2KCl + 3O_2 (\text{при катализаторе}) \\ 4KClO_3 = KCl + 3KClO_4$
Прочитано
Отметь, если полностью прочитал текст
Не диетическое использование
Только около 6% соли, производимой в мире, используется в пищевых продуктах. Из оставшейся части 12% используется в процессах водоподготовки, 8% идет на борьбу с обледенением автомагистралей и 6% используется в сельском хозяйстве. Хлорид натрия — одно из самых объемных неорганических сырьевых материалов. Его основными химическими продуктами являются каустическая сода и хлор . Они используются при производстве ПВХ , бумажной массы и многих других неорганических и органических соединений. Соль также используется в качестве флюса при производстве алюминия . Для этого слой расплавленной соли плавает поверх расплавленного металла и удаляет железо и другие металлические загрязнения. Он также используется в производстве мыла и глицерина , где он используется для омыления жиров. В качестве эмульгатора соль используется при производстве синтетического каучука , а также при обжиге гончарных изделий , когда соль, добавляемая в печь, испаряется, прежде чем конденсироваться на поверхности керамического материала, образуя прочную глазурь .
При бурении рыхлых материалов, таких как песок или гравий, к буровому раствору может быть добавлена соль, чтобы обеспечить стабильную «стенку», предотвращающую обрушение скважины. Есть много других процессов, в которых участвует соль. К ним относятся его использование в качестве протравы при крашении текстиля , для регенерации смол при умягчении воды, для дубления кож, консервирования мяса и рыбы и консервирования мяса и овощей.
Химические свойства солей
Здесь тоже есть важная особенность. Как и физические, химические свойства солей зависят от их состава. А также от того, к какому классу они относятся.

Но общие свойства солей можно все-таки выделить:
- многие из них разлагаются при нагревании с образованием двух оксидов: кислотного и основного, а бескислородные — металла и неметалла;
- взаимодействуют соли и с другими кислотами, но реакция идет, только если в составе соли кислотный остаток слабой или летучей кислоты или в результате получается нерастворимая соль;
- взаимодействие со щелочью возможно, если катион образует нерастворимое основание;
- возможна реакция и между двумя разными солями, но только если одна из вновь образовавшихся солей не растворяется в воде;
- может происходить и реакция с металлом, но она возможна, только если брать металл, расположенный правее в ряду напряжения от металла, содержащегося в соли.
Химические свойства солей, относящихся к нормальным, рассмотрены выше, другие же классы реагируют с веществами несколько иначе. Но отличие идет только по продуктам на выходе. В основном все химические свойства солей сохраняются, как и требования к протеканию реакций.
Химические свойства комплексных солей (на примере соединений алюминия и цинка)
В рамках программы ЕГЭ по химии следует усвоить химические свойства таких комплексных соединений алюминия и цинка, как тетрагидроксоалюминаты и третрагидроксоцинкаты.
Тетрагидроксоалюминатами и тетрагидроксоцинкатами называют соли, анионы которых имеют формулы [Al(OH)4]— и [Zn(OH)4]2- соответственно. Рассмотрим химические свойства таких соединений на примере солей натрия:
Данные соединения, как и другие растворимые комплексные, хорошо диссоциируют, при этом практически все комплексные ионы (в квадратных скобках) остаются целыми и не диссоциируют дальше:
Действие избытка сильной кислоты на данные соединения приводит к образованию двух солей:
При действии же на них недостатка сильных кислот в новую соль переходит только активный металл. Алюминий и цинк в составе гидроксидов выпадают в осадок:
Осаждение гидроксидов алюминия и цинка сильными кислотами не является удачным выбором, поскольку сложно добавить строго необходимое для этого количество сильной кислоты, не растворив при этом часть осадка. По этой причине для этого используют углекислый газ, обладающий очень слабыми кислотными свойствами и благодаря этому не способный растворить осадок гидроксида:
В случае тетрагидроксоалюмината осаждение гидроксида также можно проводить, используя диоксид серы и сероводород:
В случае тетрагидроксоцинката осаждение сероводородом невозможно, поскольку в осадок вместо гидроксида цинка выпадает его сульфид:
При упаривании растворов тетрагидроксоцинката и тетрагидроксоалюмината с последующим прокаливанием данные соединения переходят соответственно в цинкат и алюминат:
Применение солей
Соли нашли свое применение, как в производственных целях, так и в нашей повседневной жизни. А сейчас давайте рассмотрим более детально и узнаем, где и какие соли чаще всего применяются.
• Соли соляной кислоты
Из этого вида солей чаще всего используют хлорид натрия и хлорид калия. Поваренную соль, которую мы с вами употребляем в пищу добывают из морской, озерной воды, а также на соляных шахтах. И если хлорид натрия мы употребляем в пищу, то в промышленности его используют для получения хлора и соды. А вот хлорид калия незаменим в сельском хозяйстве. Его применяют, как калийное удобрение.
• Соли серной кислоты
Что же касается солей серной кислоты, то они нашли широкое применение в медицине и строительстве. С ее помощью изготавливают гипс.
• Соли азотной кислоты
Соли азотной кислоты, или как их еще называют нитраты, применяются в сельском хозяйстве в качестве удобрений. Самыми значимыми среди этих солей является нитрат натрия, нитрат калия, нитрат кальция и нитрат аммония. Их еще называют селитрами.
• Ортофосфаты
Среди ортофосфатов, одним из наиболее важных, является ортофосфат кальция. Эта соль входит в основу таких минералов, как фосфориты и апатиты, которые необходимы при изготовлении фосфорных удобрений.
• Соли угольной кислоты
Соли угольной кислоты или карбонат кальция можно встретит в природе, в виде мела, известняка и мрамора. Его используют для изготовления извести. А вот карбонат калия применяется, как составляющая сырья при производстве стекла и мыла.
Химические свойства солей
1. Взаимодействие растворов солей с металлами
Более активные металлы вытесняют из солей менее активные металлы:
Fe + CuSO4 → Cu + FeSO4
Железо является более активным металлом, чем медь, так как стоит левее в ряду активностей металлов, следовательно вытесняет медь из ее соли. Такие реакции протекают в растворах, следовательно, соли должны быть растворимыми.
Ag + CuSO4 → реакция не идет, так как серебро стоит правее меди в ряду активностей металлов и, следовательно, является более слабым металлом.
2. Соли вступают в реакции ионного обмена с щелочами:
Условия: 1) оба реагента должны быть растворимыми; 2) должен выпадать осадок или выделяться газ.
2NaOH + ZnCl2 → Zn(OH)2 + 2NaCl
NaOH + NH4NO3 → NH3 + NaNO3 + H2O
Cu(OH)2 + NaNO3 → реакция не идет, так как гидроксид меди (II) нерастворим.
3. Соли вступают в реакции ионного обмена с кислотами:
Условие: должен выделяться газ, выпадать осадок или образовываться более слабая кислота:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
AgNO3 + HCl → AgCl + HNO3
K3PO4 + HCl → NaCl + H3PO4 (слабая кислота)
4. Некоторые соли могут вступать в окислительно-восстановительные реакции.
1) Соли, проявляющие окислительные свойства: соли кислородсодержащих кислот галогенов (KClO3, KClO4 и др.), KMnO4, K2CrO7, нитраты (KNO3 и др) и некоторые другие.
2KClO3 + 3FeSO4 + 12KOH → 2KCl + 3K2FeO4 + 3K2SO4 + 6H2O
3KBrO4 + 8NH3 → 3KBr + 4N2 + 12H2O
2KMnO4 + 5Na2SO3 + 3H2SO4 → 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2OK2Cr2O7 + 3KNO2 + 8HNO3 → 2Cr(NO3)3 + 5KNO3 + 4H2OKNO3 + MnO2 + 2KOH → KNO2 + K2MnO4 + H2O
2FeCl3 + Fe → 3FeCl2
2) Соли, прявляющие восстановительные свойства: соли Fe+2, Cr+2, Cr+3, Sn+2, Cu+, K2S и сульфиды, K2SO3 и сульфиты и некоторые другие.
2CrCl2 + 4H2SO4(к) → Cr2(SO4)3 + SO2 + 4HCl + 2H2OCr2O3 + NaClO3 + 2K2CO3 → 2K2CrO4 + NaCl + 2CO2Cu2S + 14HNO3(к) → H2SO4 + 2Cu(NO3)2 + 10NO2 + 6H2O
3Na2S + K2Cr2O7 + 7H2SO4 → 3S + Cr2(SO4)3 + K2SO4 + 3Na2SO4 + 7H2ONa2SO3 + H2O2 → Na2SO4 + H2O
5. Химические свойства кислых солей
1) Реагируют с металлами:
2KНSO4 + Ca → CaSO4 + K2SO4 + H2
2NaHSO4 + Zn → ZnSO4 + Na2SO4 + H2
2) Реагируют с оксидами и гидроксидами металлов:
2KHSO4 + MgO → MgSO4 + K2SO4 + H2O
2KHSO4 + 2NaOH → K2SO4 + Na2SO4 + 2H2O
2KHSO4 + Cu(OH)2 → K2SO4 + CuSO4 + 2H2O
3) Реагирую с солями, если выделяется газ или образуется осадок:
2KHSO4 + CaCO3 → K2SO4 + CaSO4 + CO2 + H2O
2KHSO4 + CaCl2 → CaSO4 + K2SO4 + 2HCl
KHS + Cu(NO3)2 → CuS + KNO3 + HNO3
AgH2PO4 + NH4Br → AgBr + NH4H2PO4
3NaHCO3 + AlCl3  → Al(OH)3 + 3NaCl + 3CO2
4) Реагируют с основаниями с образованием средних солей:
KНСO3 + KОН → K2СO3 + H2O
NaHCO3 + KOH → KNaCO3 + H2O
2KHCO3 + Ba(OH)2 → BaCO3 + K2CO3 + 2H2O
KHCO3 + Ba(OH)2(изб.)  → BaCO3 + KOH + H2O
Ca(H2PO4)2 + 2Ca(OH)2 → Ca3(PO4)2 + 4H2O
3Mg(H2PO4)2 + 12KOH → Mg3(PO4)2 + 4K3PO4 + 12H2O
2NH4H2PO4 + 3Ba(OH)2 → Ba3(PO4)2 + 2NH3 + 6H2O
5) Реагируют с кислотами с образованием средних солей, если выделяется газ или образуется осадок:
NaHCO3 + HCl → NaCl + H2O + CO2
2KHS + H2SO4 → K2SO4 + 2H2S
6) Разлагаются при нагревании:
Ca(HCO3)2 → CaCO3 + CO2 + H2O (t)
Mg(HCO3)2 → MgCO3 + CO2 + H2O (t)
2NaHCO3 → Na2CO3 + CO2 + H2O (t)
NH4HCO3 → NH3 + CO2+ H2O (t)
6. Химические свойства комплексных солей
1) Реагируют с CO2 и SO2 с образованием амфотерных гидроксидов (могут образовываться как средние, так и ксилые соли):
Na[Al(OH)4] + CO2 → NaHCO3 + Al(OH)3 или
2Na[Al(OH)4] + CO2 → Na2CO3 + 2Al(OH)3 + H2O
K3[Cr(OH)6]+ 3SO2 → 3KHSO3 + Cr(OH)3
2) Реагируют с кислотами (могут образовываться как средние, так и ксилые соли)
Na[Al(OH)4] + HCl → NaCl + Al(OH)3 + H2O
K3[Cr(OH)6] + 3HNO3 → 3KNO3 + Cr(OH)3 + 3H2O
K[Al(OH)4] + H2S(изб.) → KHS + Al(OH)3 + H2O
Но:
K2[Zn(OH)4] + 3H2S → 2KHS + ZnS + 4H2O
3) Разлагаются при нагревании:
Na[Al(OH)4] → NaAlO2 + 2H2O (t)
K2[Zn(OH)4] → K2ZnO2 + 2H2O (t)
7. Разложение средних солей при нагревании
1) Нерастворимые карбонаты разлагаются при нагревании:
CaCO3 → CaO + CO2 (t)
FeCO3 → FeO + CO2 (t)
MgCO3 → MgO + CO2 (t)
2) Нитраты разлагаются при нагревании. Продукты зависят от положения металла в ряду активности металлов:
| MNO3 → MNO2 + O2 | M – металл, находящийся в ряду активности металлов левее Mg, исключая Li. |
| MNO3 → MO + NO2 + O2 | M – металл, находящийся в ряду активности металлов от Mg до Cu (Mg и Cu включительно), а также Li. |
| MNO3 → M + NO2 + O2 | M – металл, находящийся в ряду активности металлов правее Cu. |
3) Соли аммония разлагаются при нагревании:
NH4Cl → NH3 + HCl (t)
(NH4)3PO4 → 3NH3 + H3PO4(t)
(NH4)2CO3 → 2NH3 + CO2+ H2O (t)
Соли аммония азотной и азотистой кислот разлагаются с изменением степени окисления:
NH4NO3 → N2O + H2O (t)
NH4NO2 → N2 + H2O (t)
4) Термическое разложение кислородсодержащих солей хлора:
2KClO3 → 2KCl + 3O2 (t, kt = MnO2)
Основные химические свойства
Характеристики солей могут существенно различаться, так как всё зависит от состава и принадлежности к определённому подклассу. Для проведения химических экспериментов нужно точно знать, как реагируют друг на друга задействованные вещества.
| Химические свойства солей | Описание | Примеры формул |
| Взаимодействие с активными металлами | Если в пробирку поместить обезжиренный кусок меди и налить небольшое количество нитрата серебра с концентрацией 1:10, то уже через несколько часов на поверхности металла появятся игольчатые кристаллы. | Cu+2AgNO3 → Cu (NO3)2+2Ag↓ 2Al+Cr2 (SO4)3→Al2 (SO4)3+2Cr↓ |
| Взаимодействие с кислотами | Химическая реакция возможна только в том случае, если кислота будет более сильной, нежели задействованная соль. | 2NaCl+H2SO4 → Na2SO4+2HCl↑ |
| Все соли отлично взаимодействуют между собой | В качестве эксперимента можно задействовать хлорид аммония и нитрит свинца. В стакан общей ёмкостью 300 мл нужно налить концентрированный раствор Pb (NO3)2 и поместить в него кристалл NH4Cl. Постепенно в используемой ёмкости начнут расти солевые кристаллы, которые внешне будут напоминать покрытые инеем растения. | NaCl+AgNO3→AgCl+NaNO3 Pb (NO3)2+2NH4Cl→2NH4NO3+PbCl2 |
| Взаимодействие с растворами щелочей | Под воздействием высоких температур многие MnAcm подвергаются разложению. В результате образуется кислотный оксид. Бескислородные соли разлагаются на неметалл и металл. Если реакции разложения будут подвергнуты MnAcm азотистой кислоты, тогда будет выделяться свободный кислород. О2 образуется также при нагревании перманганата калия. | CaCO3 → CaO+CO2↑, 2NaCl →2Na + Cl2↑ 2KMnO4→K2MnO4+MnO2+O2↑ |
Что в химии называется солями
Согласно ИЮПАК, соли представляют собой химические соединения, в компонентный состав которых включены катионы и анионы. По другому определению название «соли» применимо к веществам, получаемым в процессе химических реакций между кислотами и основаниями, что сопровождается выделением воды.
Помимо катионов металлов, компонентами солей могут выступать:
- катионы аммония (NH4)+;
- катионы фосфония (PH4)+;
- производные органического происхождения перечисленных катионов;
- комплексные катионы.
Анионами в солях являются анионы кислотного остатка разных органических и неорганических кислот Бренстеда, в том числе карбанионы и комплексные анионы.
В распространенных случаях соли имеют вид кристаллических веществ с ионной кристаллической решеткой. К примеру, кристаллы галогенидов щелочных и щелочноземельных металлов (NaCl, CsCl, CaF2) состоят из анионов, которые размещены, согласно принципу плотнейшей шаровой упаковки, и катионов, встающие на пустые места в этой упаковке. Ионные кристаллы солей могут быть сложены из кислотных остатков, которые объединены в бесконечные анионные фрагменты и трехмерные каркасы с катионами в полостях (силикаты).
Рассмотренное строение обуславливает физические свойства солей:
- повышенные показатели температурного режима плавления;
- в твердом агрегатном состоянии вещества обладают диэлектрическими свойствами;
- проводят электрический ток в растворах и расплавах.
Некоторые соли обладают характером химических связей, который является промежуточным между ионным и ковалентным. Например, хлорид алюминия AlCl3, в газовой фазе состои из молекул AlCl3 или Al2Cl6.
Особенно важны для науки ионные жидкости в виде солей, которые плавятся при температуре ниже 100 °С. Ионные жидкости характеризуются не только аномальной температурой плавления, но и обладают почти нулевым давлением насыщенного пара и высокой вязкостью. Уникальные свойства данных солей объясняются следующими факторами:
- низкая симметрия катиона;
- слабое взаимодействие между ионами;
- хорошие распределение заряда катиона.
Ключевое свойство солей заключается в степени их растворимости в воде. Согласно данному критерию вещества классифицируют на следующие классы:
- растворимые;
- мало растворимые;
- нерастворимые.
Разложение карбонатов и гидрокарбонатов
Карбонаты натрия и калия плавятся при нагревании.
Карбонаты лития, щелочноземельных металлов и магния разлагаются на оксид металла и углекислый газ:
Li2CO3 → Li2O + CO2
CaCO3 → CaO + CO2
MgCO3 → MgO + CO2
Карбонат аммония разлагается при 30оС на гидрокарбонат аммония и аммиак:
(NH4)2CO3 → NH4HCO3 + NH3
Гидрокарбонат аммония при дальнейшем нагревании разлагается на аммиак, углекислый газ и воду:
NH4HCO3 → NH3 + CO2 + H2O
Гидрокарбонаты натрия и калия при нагревании разлагаются на карбонаты, углекислый газ и воду:
2NaHCO3 → Na2CO3 + H2O + CO2
2KHCO3 → K2CO3 + H2O + CO2
Гидрокарбонат кальция при нагревании до 100оС разлагается на карбонат, углекислый газ и воду:
Ca(HCO3)2 → CaCO3 + H2O + CO2
При нагревании до 1200оС образуются оксиды:
Ca(HCO3)2 → CaO + H2O + 2CO2