Разбавление — концентрированная серная кислота
Разбавление концентрированной серной кислоты следует производить, приливая кислоту в воду, а не наоборот. В противном случае возможно вскипание жидкости и ее разбрызгивание. Кислоту следует приливать малыми порциями или очень тонкой струей при непрерывном перемешивании раствора. При сильном разогревании раствора следует дать ему охладиться.
Разбавление концентрированной серной кислоты и растворение едких щелочей проводят в фарфоровой посуде ( стаканах, чашках), так как эти процессы сопровождаются выделением большого количества тепла. При разбавлении серной кислоты ее следует медленно приливать в воду, все время перемешивая. Приливание воды в кислоту категорически запрещается, что обусловлено бурным вскипанием и разбрызгиванием горячей кислоты, которая может вызвать тяжелые ожоги.
Для разбавления концентрированной серной кислоты удобно пользоваться правилом креста.
Для разбавления концентрированной серной кислоты ее следует тонкой струей вливать в воду, перемешивая при этом раствор; воду нельзя приливать к кислоте, так как это вызовет разбрызгивание кислоты.
SOt-Для разбавления концентрированной серной кислоты ее следует тонкой струей вливать в воду, перемешивая при этом раствор; воду нельзя приливать к кислоте, так как это вызовет вскипание и сильное разбрызгивание кислоты.
При разбавлении концентрированной серной кислоты, при смешивании концентрированной серной и азотной кислот и вообще, если смешивание веществ сопровождается выделением тепла, можно пользоваться только тонкостенной химической посудой из стекла или фарфоровой посудой.
При разбавлении концентрированной серной кислоты, при смешивании концентрированной серной и азотной кислот и, вообще, если смешивание веществ сопровождается выделением тепла можно пользоваться только тонкостенной химической посудой из стекла или фарфоровой посудой.
При разбавлении концентрированной серной кислоты вливают кислоту в воду небольшими порциями, при помешивании.
При разбавлении концентрированной серной кислоты следует медленно и осторожно приливать кислоту к воде, но не наоборот. Так как при разбавлении кислоты выделяется большое количество тепла, то при приливании воды к кислоте может произойти разбрызгивание кислоты.
При разбавлении концентрированной серной кислоты водой необходимо вливать кислоту тонкой струйкой в воду, а не наоборот, так как лри разбавлении кислоты выделяется большое количество тепла
Если ввести в кислоту небольшое количество воды, последняя мгновенно вскипит и кислоту вместе с паром может выбросить из чана.
При разбавлении концентрированной серной кислоты водой необходимо вливать кислоту тонкой струйкой в воду, а не наоборот, так как лри разбавлении кислоты выделяется большое количество тепла. Если ввести в кислоту небольшое количество воды, последняя мгновенно вскипит и кислоту вместе с паром может выбросить из чана.
При разбавлении концентрированной серной кислоты водой следует постепенно вливать кислоту в холодную воду, постоянно помешивая.
При разбавлении концентрированной серной кислоты вливают кислоту в воду небольшими порциями, при помешивании.
При разбавлении концентрированной серной кислоты следует медленно и осторожно приливать кислоту в воду, но не наоборот. При разбавлении кислоты выделяется большое количество тепла, поэтому при при-ливании воды к кислоте может произойти разбрызгивание кислоты.
При разбавлении концентрированной серной кислоты ни в коем случае не разрешается вливать в нее воду ( или разбавленную кислоту), так как смешение кислоты с водой сопровождается выделением большого количества тепла, и первые капли воды ( или разбавленной серной кислоты), попадая в концентрированную кислоту, вызовут ее быстрое вскипание и разбрызгивание.
При разбавлении концентрированной серной кислоты ни в коем случае не разрешается вливать в нее воду ( или разбавленную кислоту), так как смешение кислоты с водой сопровождается выделением большого количества тепла, и первые капли воды ( или разбавленной серной кислоты), попадая в концентрированную кислоту, вызовут ее быстрое вскипание и разбрызгивание.
При разбавлении концентрированной серной кислоты, при смешивании концентрированной серной и азотной кислот и вообще, если смешивание веществ сопровождается выделением тепла; можно пользоваться только тонкостенной химической посудой из стекла или фарфоровой посудой.
Примечания и ссылки
- Понятие кислоты Льюиса охватывает другие понятия кислоты, описанные ниже.
- Замечание аналогично для баз. Поскольку понятия основания и кислоты могут быть объединены, это следует за существованием кислотно-основных пар, участвующих на элементарном уровне в кислотно-основных реакциях .
- Термин классический, с глаголом ǎcǐdāre, означающим «кислый или кислый, чтобы стать» прилагательным ǎcǐdǔlus, a, um «кислый» в происхождении французского слова щавель через acidula , наречие ăc thedē «такой горький, болезненный, неприятный» или существительное женского ǎcǐdǐtās цитируемые в IV — м веке врач Марцелл Эмпирик с чувством , в первую очередь лекарственного, но и вообще из «горечи».
- Партингтон JR (1989), Краткая история химии , ред. Довер, стр. 31 год
- .
- (in) в Интернет-архиве (по состоянию на 7 ноября 2020 г. ) .
- Партингтон JR (1989), Краткая история химии , ред. Довер, стр. 39
- Партингтон JR (1989), Краткая история химии , ред. Довер, стр. 63
- Партингтон JR (1989), Краткая история химии , ред. Довер, стр. 60
- Партингтон JR (1989), Краткая история химии , ред. Довер, стр. 76
- Партингтон JR (1989), Краткая история химии , ред. Довер, стр. 196
- (in) » » Сборник химической терминологии , ИЮПАК 1997, исправленная онлайн-версия (2006-), 2- е изд.
- Эндрю Хант, «Химия от А до Я, 1200 определений», Dunod, 2006
- Последний объект иногда описывается в полностью гидроксилированной форме, Si (OH) 4 или его мезомер H 2 SiO 3 .H 2 O
Измерение веса стаканом
Стакан также часто выступает мерилом веса продуктов в рецептах. Он используется для измерения количества сыпучих ингредиентов, например, муки, а также жидких, если подразумевается большой объем, уксуса, например, для консервации. Однако стаканов много и все они разные по размеру и вместимости. Обычно мерной емкостью является граненый стакан объемом 250 грамм. В зависимости от продукта стаканом можно измерить следующие компоненты блюд:
молоко – 250 г;
мед – 330 г;
крахмал – 128 г;
изюм – 190 г;
мука – 140 г;
какао – 100 г;
гречка – 210 г;
овсянка – 90 г.
рис – 150 г;
клубника – 170 г;
вишня – 170 г;
кокосовая стружка – 75 г.
Хорошо, когда на кухне есть мерные емкости разных объемов, однако если их нет, с этой ролью успешно справляются такие привычные столовые приборы, как ложки и стаканы.
Список источников
- www.ngpedia.ru
- topask.ru
- megagiper.ru
- ProUksus.ru
- drDobrov.com
Возможные побочные эффекты и риски
Пить кислую воду не рекомендуется, поскольку ее высокая кислотность и концентрация тяжелых металлов могут иметь несколько негативных последствий для здоровья.
Может содержать тяжелые металлы
Одна из основных проблем с кислой водой заключается в том, что она часто содержит большое количество тяжелых металлов ().
Исследования показали, что растворы с более низким уровнем pH с большей вероятностью выщелачивают тяжелые металлы из окружающей среды. В результате раствор – в данном случае вода – имеет более высокую концентрацию тяжелых металлов (, ).
В частности, кислая вода может содержать большое количество свинца, мышьяка, меди, никеля, кадмия, хрома и цинка (, ).
Это вызывает обеспокоенность, поскольку воздействие тяжелых металлов может быть опасным, потенциально приводя к отравлению тяжелыми металлами и токсичности, симптомы которых включают следующие (, ):
- диарея
- тошнота и рвота
- боль в животе
- озноб
- слабость
- одышка
- подавление иммунной системы
- повреждение органов
Тяжесть этих побочных эффектов зависит от нескольких факторов, включая возраст, пол, индивидуальную восприимчивость, а также путь, дозу и частоту воздействия ().
В частности, было выявлено, что дети имеют более серьезные побочные эффекты от воздействия тяжелых металлов, включая повышенный риск задержки развития, респираторные проблемы, поведенческие расстройства, определенные формы рака и заболевания сердца (, ).
Может быть вредна для ваших зубов
Уровень pH продуктов питания и напитков играет важную роль в общем здоровье зубов.
В частности, зубная эмаль – твердая внешняя поверхность ваших зубов, которая защищает их от кариеса – подвержена повреждению кислыми напитками ().
Хотя кислотные грунтовые воды специально не изучались, было выявлено, что напитки с pH 4,5 или ниже повышают риск кариеса. Таким образом, регулярное употребление кислой воды может медленно разрушать зубную эмаль, вызывая кариес (, ).
Может быть вредна для здоровья костей
Утверждается, что потребление кислой воды препятствует усвоению кальция и со временем приводит к потере костной массы.
Тем не менее исследования не показали, что pH вашего рациона значительно влияет на риск потери костной массы, и не доказали, что употребление щелочной воды оказывает защитный эффект ().
Однако воздействие некоторых тяжелых металлов, включая свинец, кадмий, мышьяк и хром, было связано с негативными побочными эффектами в отношение здоровья костей (, ).
Следовательно, регулярное воздействие кислой воды с высоким содержанием этих тяжелых металлов может со временем отрицательно сказаться на здоровье костей.
Может повредить сантехнику в вашем доме
Кислая вода не только наносит вред вашему организму, но и разъедает трубы.
Из-за своей высокой кислотности вода с низким pH со временем может начать растворять металлические трубы, вызывая протечку и еще больше увеличивая присутствие тяжелых металлов в питьевой воде ().
Признаками того, что ваши трубы могут подвергаться коррозии из-за кислой воды, являются сине-зеленые пятна на ваших кранах или в раковине, вода с металлическим привкусом и протечки в водопроводе ().
Способ применения и дозы
У взрослых
ЦИТОФЛАВИН применяют только внутривенно капельно в разведении на 100–200 мл 5–10 % раствора декстрозы или 0,9 % раствора натрия хлорида. Скорость введения 3–4 мл/мин.
1. При инфаркте мозга препарат вводят в максимально ранние сроки от начала развития заболевания в объёме 10 мл на введение с интервалом 8–12 часов в течение 10 дней. При
тяжёлой форме течения заболевания разовую дозу увеличивают до 20 мл.
2. При последствиях цереброваскулярных болезней (инфаркта мозга, церебрального атеросклероза) препарат вводят в объёме 10 мл на введение один раз в сутки в течение 10 дней.
3. При токсической и гипоксической энцефалопатии препарат вводят в объёме 10 мл на введение два раза в сутки через 8–12 часов в течение 5 дней. При коматозном состоянии –
в объёме 20 мл на введение в разведении на 200 мл раствора декстрозы. При посленаркозном угнетении сознания – однократно в тех же дозах. В терапии гипоксической энцефалопатии при кардиохирургических операциях с использованием искусственного кровообращения вводят по 20 мл препарата в разведении на 200 мл 5 % раствора декстрозы за 3 дня до операции, в день операции, в течение 3 дней после операции.
4. Для профилактики когнитивных расстройств после обширных хирургических вмешательств у пациентов пожилого возраста препарат вводят в объёме 20 мл на введение в разведении на 200 мл 0,9 % раствора натрия хлорида. Курс лечения – 7 дней по схеме: первое введение — за сутки до операции; второе – интраоперационное введение после осуществления вводного наркоза (начало инфузии в течение 30 минут от начала операции), затем в течение 5 дней после операции. В дальнейшем рекомендуется применение препарата «ЦИТОФЛАВИН таблетки, покрытые кишечнорастворимой оболочкой» по 2 таблетки 2 раза в сутки
с интервалом между приёмами 8–10 часов в течение 25 дней.
У детей (в том числе недоношенных) в периоде новорождённости с церебральной ишемией суточная доза препарата ЦИТОФЛАВИН составляет 2 мл/кг. Рассчитанную суточную дозу препарата вводят внутривенно капельно (медленно) после разведения в 5 % или 10 % растворе декстрозы (в соотношении не менее 1:5). Время первого введения – первые 12 часов после рождения; оптимальным временем для начала терапии являются первые 2 часа жизни. Рекомендуется вводить приготовленный раствор с помощью инфузионного насоса со скоростью от 1 до 4 мл/ч, обеспечивая равномерное поступление препарата в кровоток в течение суток, в зависимости от рассчитанного суточного объёма растворов для базисной терапии, состояния гемодинамики пациента и показателей кислотно-основного состояния. Курс лечения составляет в среднем 5 суток.
Советы по теме статьи
Чтобы ускорить процесс очищения и облегчить работу, рекомендуется учитывать степень коррозии, характер поверхности и другие нюансы.
Специалисты советуют:
- Значительный слой ржавчины перед использованием химического очистителя целесообразно сначала зачистить наждачной бумагой крупной зернистости, металлической щеткой, ножом или болгаркой.
- Если поверхность после очищения планируется покрыть лаком или краской, то желательно применять не чистый раствор кислоты, а заводской ортофосфорный преобразователь, содержащий дополнительные ингредиенты.
- При поверхностном методе раствор наносят только на участок, подвергшийся коррозии. Чтобы обезопасить неповрежденное покрытие вокруг пятна, его прикрывают полиэтиленовой пленкой.
- При проведении процедуры очищения в квартире, необходимо включить вентиляцию и открыть окна.
- До и после использования порошок и жидкость ортофосфорной кислоты должны храниться в герметично закрытых емкостях при комнатной температуре, на недоступных для детей полках.
ПРАКТИКУМ: Коррекция pH-значения водного раствора
1. Налейте 1 литр водопроводной воды в какую-нибудь ёмкость, например, в кувшин или кастрюлю. С помощью измерьте текущее pH-значение вашей воды:

2. Предположим, pH вашей воды сейчас равен 7,29, а вам для приготовления гидропонного раствора требуется снизить это значение до pH 6,0 (т. е., примерно на 1,3 pH).
Чтобы скорректировать pH до нужного значения, наберите кислоту в пипетку и понемногу — по 1-2 капли! — добавляйте её в воду до достижения нужного показателя, периодически помешивая раствор для более равномерного распределения:

3. Чтобы в дальнейшем ускорить процедуру и быстрее производить коррекцию больших объёмов воды со сходными параметрами (к примеру, для приготовления раствора или долива воды сразу в несколько контейнеров), запишите, сколько капель кислоты вам понадобилось для коррекции 1 л такой воды и умножьте это число на целевое количество литров.
Имеющиеся противопоказания
Несмотря на всю возможную пользу для здоровья, от идеи начать пить лимонную кислоту с водой придется отказаться при наличии следующих противопоказаний:
Любые хронические заболевания желудочно-кишечного тракта, особенно в стадии обострения (гастрит, колит, язва желудка и двенадцатиперстной кишки).
Повышенная кислотность желудочного сока. Лимонная кислота еще усилит изжогу.
Курсовой прием препаратов, имеющих целью снижение концентрации соляной кислоты в желудочном соке.
Проблемы и/или воспалительные процессы в выделительной системе (почки, мочевой пузырь), особенно почечная недостаточность.
Патологии печени и желчного пузыря, камни в нем (и в почках).
Сахарный диабет любого типа и прочие заболевания, «сбивающие» нормальный гормональный фон. Предсказать, как организм в таком состоянии отреагирует на любой непривычный внешний «раздражитель», совершенно невозможно.
Стоматит, иные подобные заболевания полости рта, при которых страдает слизистая.
Аллергия. Это явление редкое, но не невозможное
Особенно осторожно «коктейль» нужно пробовать тем, кто знает о наличии у себя склонности к подобным реакциям.
При любом хроническом заболевании, даже если кажется, что вода с лимонной кислотой никак не ухудшит состояние здоровья, необходимо проконсультироваться с лечащим врачом на предмет возможности регулярного употребления.
Разбавление — концентрированная серная кислота
Разбавление концентрированной серной кислоты следует производить, приливая кислоту в воду, а не наоборот. В противном случае возможно вскипание жидкости и ее разбрызгивание. Кислоту следует приливать малыми порциями или очень тонкой струей при непрерывном перемешивании раствора. При сильном разогревании раствора следует дать ему охладиться.
Разбавление концентрированной серной кислоты и растворение едких щелочей проводят в фарфоровой посуде ( стаканах, чашках), так как эти процессы сопровождаются выделением большого количества тепла. При разбавлении серной кислоты ее следует медленно приливать в воду, все время перемешивая. Приливание воды в кислоту категорически запрещается, что обусловлено бурным вскипанием и разбрызгиванием горячей кислоты, которая может вызвать тяжелые ожоги.
Для разбавления концентрированной серной кислоты удобно пользоваться правилом креста.
Для разбавления концентрированной серной кислоты ее следует тонкой струей вливать в воду, перемешивая при этом раствор; воду нельзя приливать к кислоте, так как это вызовет разбрызгивание кислоты.
SOt-Для разбавления концентрированной серной кислоты ее следует тонкой струей вливать в воду, перемешивая при этом раствор; воду нельзя приливать к кислоте, так как это вызовет вскипание и сильное разбрызгивание кислоты.
При разбавлении концентрированной серной кислоты, при смешивании концентрированной серной и азотной кислот и вообще, если смешивание веществ сопровождается выделением тепла, можно пользоваться только тонкостенной химической посудой из стекла или фарфоровой посудой.
При разбавлении концентрированной серной кислоты, при смешивании концентрированной серной и азотной кислот и, вообще, если смешивание веществ сопровождается выделением тепла можно пользоваться только тонкостенной химической посудой из стекла или фарфоровой посудой.
При разбавлении концентрированной серной кислоты вливают кислоту в воду небольшими порциями, при помешивании.
При разбавлении концентрированной серной кислоты следует медленно и осторожно приливать кислоту к воде, но не наоборот. Так как при разбавлении кислоты выделяется большое количество тепла, то при приливании воды к кислоте может произойти разбрызгивание кислоты.
. При разбавлении концентрированной серной кислоты водой необходимо вливать кислоту тонкой струйкой в воду, а не наоборот, так как лри разбавлении кислоты выделяется большое количество тепла
Если ввести в кислоту небольшое количество воды, последняя мгновенно вскипит и кислоту вместе с паром может выбросить из чана.
При разбавлении концентрированной серной кислоты водой необходимо вливать кислоту тонкой струйкой в воду, а не наоборот, так как лри разбавлении кислоты выделяется большое количество тепла. Если ввести в кислоту небольшое количество воды, последняя мгновенно вскипит и кислоту вместе с паром может выбросить из чана.
При разбавлении концентрированной серной кислоты водой следует постепенно вливать кислоту в холодную воду, постоянно помешивая.
При разбавлении концентрированной серной кислоты вливают кислоту в воду небольшими порциями, при помешивании.
При разбавлении концентрированной серной кислоты следует медленно и осторожно приливать кислоту в воду, но не наоборот. При разбавлении кислоты выделяется большое количество тепла, поэтому при при-ливании воды к кислоте может произойти разбрызгивание кислоты.
. При разбавлении концентрированной серной кислоты ни в коем случае не разрешается вливать в нее воду ( или разбавленную кислоту), так как смешение кислоты с водой сопровождается выделением большого количества тепла, и первые капли воды ( или разбавленной серной кислоты), попадая в концентрированную кислоту, вызовут ее быстрое вскипание и разбрызгивание.
При разбавлении концентрированной серной кислоты ни в коем случае не разрешается вливать в нее воду ( или разбавленную кислоту), так как смешение кислоты с водой сопровождается выделением большого количества тепла, и первые капли воды ( или разбавленной серной кислоты), попадая в концентрированную кислоту, вызовут ее быстрое вскипание и разбрызгивание.
При разбавлении концентрированной серной кислоты, при смешивании концентрированной серной и азотной кислот и вообще, если смешивание веществ сопровождается выделением тепла; можно пользоваться только тонкостенной химической посудой из стекла или фарфоровой посудой.
Солевые полоскания
Солевой раствор можно отнести к одним из наиболее популярных средств для полоскания при боли или воспалении в горле. Его эффективность обусловлена способностью предотвращать пересыхание слизистой оболочки глотки и миндалин, и таким образом препятствовать образованию микротрещин, а также дальнейшему развитию воспалительного процесса .
Положительный эффект дает полоскание морской водой. В отличие от раствора натрия хлорида, морская вода оказывает некоторое антисептическое действие за счет содержания йода. К тому же в ее состав входят микроэлементы, способствующие укреплению местного иммунитета, такие как цинк и селен.
Гипертонические растворы оказывают осмотическое и тканевое давление на микрофлору, вследствие чего нарушается функция клеточных мембран и бактерии погибают. Не следует сбрасывать со счетов и возможность солевых растворов механически смывать возбудителей инфекции с миндалин и задней стенки глотки .
Полоскание солевыми растворами рекомендуют назначать при боли в горле не только отечественные, но и западные специалисты . Раствор натрия хлорида и морская вода помогают уменьшить выраженность легкой и умеренной боли в горле, однако при сильном болевом синдроме, согласно международным рекомендациям по лечению боли в горле, следует сочетать его с приемом анальгетиков, таких как парацетамол и ибупрофен .
Кстати, вполне можно предложить посетителю, которого тревожит сильная боль в горле, сочетать полоскание с приемом безрецептурных НПВП. Таким образом, получаем уместную и «клинически обоснованную» допродажу ЛС.
Необходимо подчеркнуть, что растворы натрия хлорида или морской соли — оптимальная рекомендация, если нужно определиться со средством для полоскания горла именно для детей, т. к. возрастных ограничений нет: главное, чтобы ребенок уже умел выполнять эту процедуру. К тому же солевые растворы для полоскания помогают не только облегчить боль в горле, но и проявляют профилактический эффект в отношении возбудителей респираторной инфекции.
По данным исследований японских ученых с участием более 19 500 детей 2–6 лет, полоскания горла раствором соли, зеленым чаем и даже водопроводной водой по крайней мере один раз в день снижали вероятность ОРВИ и лихорадки при ОРВИ .
В ассортименте аптек солевые растворы в основном представлены в спреях для орошения. Для полоскания можно предложить раствор натрия хлорида изотонический, стерильный для инфузий или остановить выбор на порошках. Как правило, они содержат еще и йод, экстракты растений и другие ингредиенты.
Какие кислоты используются для понижения pH?

• азотная кислота (HNO3). Поскольку она привносит в раствор дополнительный нитратный азот (один из макроэлементов, необходимых растению), эта кислота обычно применяется на стадии вегетации, в ходе которой растения могут использовать этот азот «по назначению», т. е. для наращивания зелёной массы. В магазинах товаров для гидропоники азотная кислота продаётся под торговыми названиями pH Down Growth либо pH Minus Growth (т. е. «понижатель pH для стадии вегетации»).
• ортофосфорная кислота (H3PO4). Поскольку данная кислота привносит в раствор дополнительный фосфор, её обычно применяют на стадии цветения и плодоношения, когда растения имеют повышенную потребность в этом макроэлементе. В магазинах товаров для гидропоники ортофосфорная кислота продаётся под торговыми названиями pH Down Bloom либо pH Minus Bloom (т. е. «понижатель pH для стадии цветения»).
• серная кислота (H2SO4) или соляная кислота (HCl), в отличие от азотной и ортофосфорной, не привносят в раствор макроэлементы, способные значимо влиять на ростовые процессы. И поскольку они обладают более нейтральным действием, авторы англоязычных книг по гидропонному выращиванию рекомендуют использовать именно их для понижения pH. (Другой вопрос, что купить эти кислоты в розницу российскому гидропонщику не так-то просто.)
Кислоты в косметике

Помимо влияния на вкусовые рецепторы, ответственные за кислый вкус, кислоты также обладают слегка едкими свойствами. В этом легко убедиться, если вы случайно нальете лимонный сок на поцарапанный палец. Это свойство используется в косметике, потому что лимон – отличное домашнее средство для красивой кожи. Он осветляет кожу и дополнительно стимулирует выработку коллагена. В косметике также используются деликатные ферментные пилинги с использованием кислот, поскольку они отлично удаляют омертвевшие клетки кожи, но для этой цели чаще всего используются другие фрукты, например папайя. Богатство фруктовых кислот используется везде, где необходимы питательные свойства путем отшелушивания.
Как сделать своими руками
Самый простой способ это найти фосфорную или ортофосфорную кислоту и смешать ее в нужной пропорции с водой, пропорции примерно такие от 60 до 70% кислоты остальное вода. Этого уже будет достаточно, чтобы убрать слой ржавчины с поверхности.
Однако не всегда легко найти этот компонент, да и тратиться на преобразователь не всегда хочется, ведь например, нужно просто обработать тормозной барабан, чтобы обезопасить поверхность перед покраской.
Тогда можно сделать из доступных компонентов своими руками, причем они есть практически у каждого дома, нам понадобиться:
- 1 литр дистиллированной воды.
- Лимонная (можно щавелевая) кислота. Берем примерно столько же сколько и воды, то есть литр, можно даже полтора.
- 15 грамм обычной соды.

Для начала делаем базу, то есть в воду добавляем кислоту и уже после этого нам нужно добавить соду. Должна пройти реакция, примерно около 30 – 40 минут, после того как она закончится, нам нужно одеть резиновую перчатку, взять ветошь и промочить ее в этом растворе. Далее просто наносим эту «тряпку» на пораженное место. Предупреждение, его желательно зачистить.
Не стоит ждать слишком сильной реакции, все же эти кислоты являются бытовыми и не обладают высокой активностью, но как вспомогательное средство. Например, зачистили тормозной барабан нужно обработать поверхность, обязательно подойдет. Также оно не может бороться с глубокой ржавчиной.
Если вам нужно средство именно для борьбы с глубокими очагами, вам нужно купить специализированный состав, ведь там большое количество активных веществ, которые подбираются по строгой, секретной формуле.
Сейчас небольшая видео инструкция, с применение ортофосфорной кислоты, смотрим.
Вот такая вот статья получилась, думаю было полезно. Читайте наш АВТОБЛОГ.
Похожие новости
- Можно ли смешивать тормозные жидкости. Скажем разных производите…
- Как открутить тормозную трубку. Если она закисла и грани сорваны…
- Противоскрипные пластины для тормозных колодок. Для чего нужны и…
Что такое паяльная кислота и для чего она нужна
Если же вы учили химию, то знаете, что среди металлов есть вещества с большой активностью.
Многие из них вступают в реакцию с воздухом, в результате чего окисляются.
Оксиды, что образовались на поверхности металлов превращаются в гидроксиды из-за воздействия влаги, что находится в атмосфере.
Подобные смеси из продуктов окисления металла называют ржавчиной.
Ржавчина и другие оксидные слои, которыми покрываются другие металлы, не позволяют ничего припаять к заготовке.
Решить эту проблему помогает кислотные флюсы, кислотность которых бывает разная. Простейшие кислотные флюсы – паяльные кислоты.
Паяльной кислотой называют группу разнообразных составов на основе одного или нескольких химических элементов, которые можно изготовить самостоятельно.
Польза и вред сульфатов
В зависимости от преобладания в сульфатной воде того или иного компонента выделяют воды:
- глауберовые (с содержанием десятиводного кристаллогидрата сульфата натрия Na2SO410H2O);
- магнезиальные (присутствует сульфат магния MgSO4);
- гипсовые (с содержанием CaSO42H2O).
Влияние на организм человека
Особенность сульфатных вод проявляется в их выраженном воздействии на пищеварительную систему. Употребление минеральной воды с преобладанием сульфатов (более 25%) способствует:
- оттоку желчи из желчного пузыря;
- стимуляции перистальтики кишечника;
- лечению метеоризма;
- выработке желчи клетками печени;
- выведению из организма продуктов воспаления, слизи, микробов;
- ускорению обменных процессов;
- переходу пищи из желудка и усвоение в кишечнике.
Избыточное количество сульфатов (более 500 мг/дм3) придает питьевой воде горький вкус, а в концентрации 1-2 г на литр сульфатная вода оказывает слабительное действие. Отмечен эффект тормозящего влияния сульфатов на реакцию утоления жажды (Егорова, 2002), в конечном итоге приводящий к увеличению нагрузки не на почки, а на кишечник.
Человеческий организм со временем адаптируется и к более высоким концентрациям солей, но допустимое содержание сульфатов по нормативам не должно превышать 500 мг/дм3, находясь в диапазоне 100-150 мг/дм3.
Водопроводы и стоковые коммуникации
Присутствие ионов Cl—, Br—, SO2-4 и NO3 увеличивает электрическую проводимость воды и, как следствие, понижает сопротивление коррозионному току. Даже минимальное (менее 1 мг/дм3) присутствие сульфатов в воде способно спровоцировать разрушение металлических труб, влияя на коррозионные процессы следующим образом:
- непосредственно — чем выше концентрация солей, тем ниже удельное сопротивление воды;
- косвенно — через деятельность сульфатвосстанавливающих бактерий, принимающих участие в биологической коррозии.
С кальцием сульфаты образуют прочную накипь. С повышением температуры воды растворимость сульфата кальция снижается, соль выделяется из воды, оседая на поверхностях труб и нагревательных элементах. Незначительные отложения состоят преимущественно из двуводного гидрата CaSO4 2H2O (гипса), но утолщение накипи приводит к нагреванию прилегающего к металлу слоя. При 100 °С гипс превращается в полуводный гидрат
CaSO4 1/2H2O, снять который крайне затруднительно даже промыванием системы кислотой.
Круговорот сульфатов в природе
Основным резервом сульфатов, вовлекаемых в природный круговорот, в настоящее время выступает самородная сера и сульфатсодержащие минералы. Осадочные породы, особенно органические сланцы, дают большие количества сульфатов путем окисления минералов с одинаковой химической формулой FeS₂ —лучистого колчедана (марказита) и пирита.
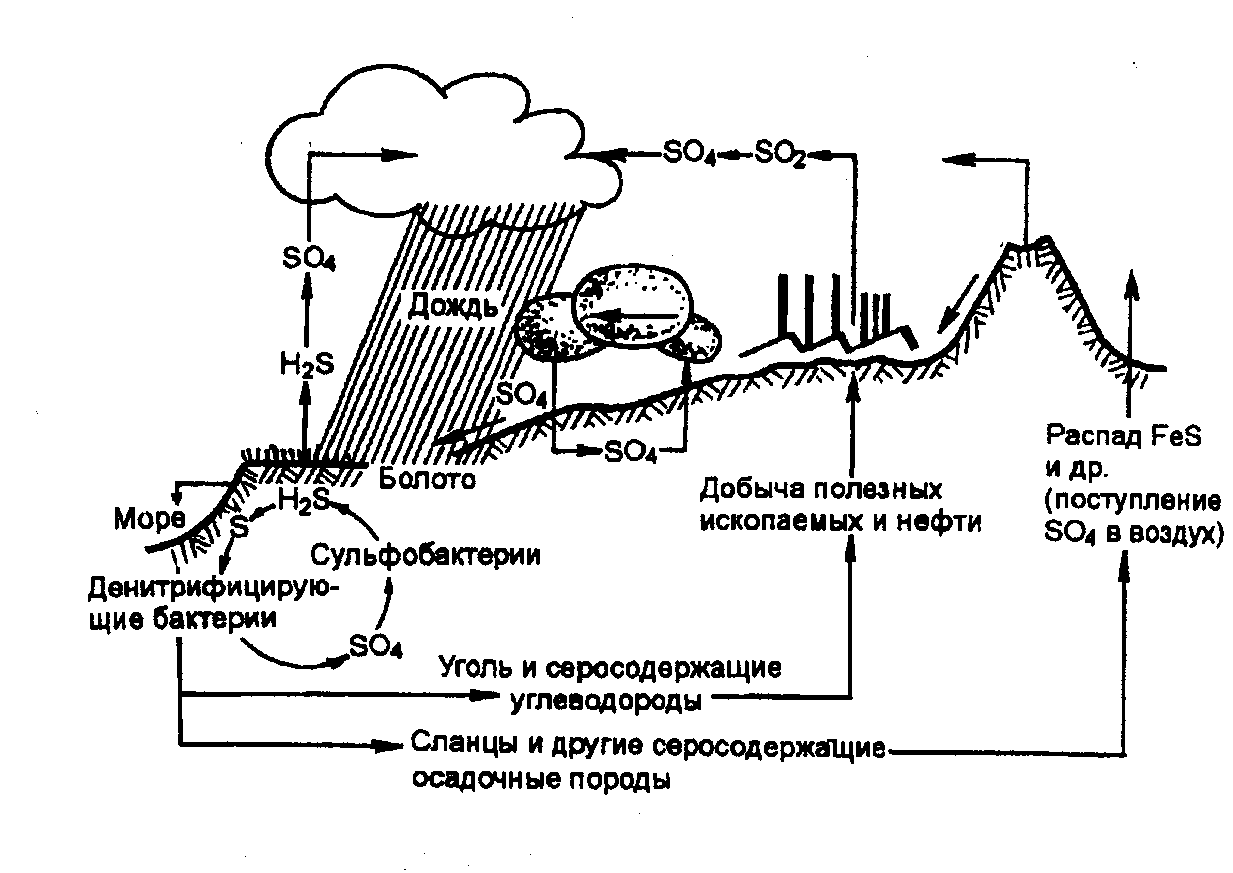
В почвенных слоях постоянно идет окислительно-восстановительный обмен серой между сульфидами серы, находящимися в бескислородных условиях в толще почвы, и доступными сульфатами вблизи поверхности. Сульфид окисляется до сульфата в присутствии воздуха, а сульфат восстанавливается до сульфида в анаэробных условиях.
В морях в результате деятельности бактерий происходит восстановление глубоководных сульфатных отложений. Образовавшийся при этом сероводород мигрирует к поверхности воды, где окисляется кислородом атмосферного воздуха до сульфат-иона.
Значительное количество сероводорода остается в подземных водах. Если в воде присутствует железо, образовавшийся FeS способен выпасть в осадок, в результате чего из воды удаляются как ионы железа, так и сульфиды.
В почве за восстановление сульфатов отвечают почвенные бактерии, в этом случае большие количества сероводорода поступают непосредственно в атмосферу.
Сульфат-ион — основная форма серы, доступная организмам-автотрофам. Сульфаты поглощаются живыми существами, благодаря метаболизму которых восстанавливаются и входят в состав белков. При гниении отмерших организмов сера возвращается в круговорот.