Содержание
Йод в организме человека
Полезные свойства йода имеют особое значение для всего человеческого организма, так как применение данного вещества в медицинской практике давно уже себя оправдало.
Как утверждают многие источники, элемент особо необходим щитовидной железе, поскольку является незаменимой составляющей ее гормонального фона.
Именно в этой части тела концентрация химического элемента составляет больше 65%, остальные 35% сосредоточены в мышечных тканях, крови, яичниках. В микрограммах это не менее 50 в сутки для детского организма, 120-150 – для взрослого, 190-210 – для беременных и кормящих женщин.
При этом влияние данного вещества на все жизненные процессы действительно неоценимо:
- йод контролирует теплорегуляцию тела;
- способствует обмену веществ, метаболизму, водно-электролитным процессам;
- отвечает за правильное развитие мышечной ткани, опорно-двигательного аппарата.
ВАЖНО! Не стоит забывать и о психологическом/эмоциональном здоровье, стабильность которого во многом зависит от концентрации микроэлемента. НО! Органы и ткани не могут самостоятельно вырабатывать галоген, поэтому для их полноценного функционирования столь важны внешние источники элемента: продукты питания, морской воздух, лекарственные препараты
Признаки нехватки йода
Настолько ли важен для человеческой жизни обычный йод? И чем грозит его дефицит?
- Постоянное чувство усталости. А еще вялость, сонливость, апатия. Именно так проявляется значительное снижение гормонов щитовидной железы, которые отвечают за жизненную энергию организма.
- Железодефицитная анемия. Сопровождает йододефицит уже на довольно запущенной стадии (бледность кожных покровов, слабость, приступы головокружения).
- Повышенная отечность. Особенно на уровне глаз. Употребление мочегонных средств для устранения такой патологии абсолютно бесполезно.
- Ослабление иммунной системы. Проявляется как неспособность защитных сил блокировать инфекционные заболевания вирусного/паразитарного типа, недуги простудного характера, грибковые заболевания.
- Лишний вес. Человек с недостатком йода испытывает хронический голод. Кроме того нарушается обмен веществ, тело пациента постепенно отекает.
- Низкое артериальное давление. Гипотония тесно связана с недостаточной деятельностью щитовидной железы, сопровождается аритмией, головными болями, одышкой.
- Снижение умственных способностей. В первую очередь страдает память, способность к рациональному мышлению, творческое начало.
- Психологическая подавленность. Депрессивное состояние, эмоциональная нестабильность, апатия.
Признаки избытка йода
Как показывает практика, все должно быть равномерно. Ведь вред йода – не выдуманный факт, поскольку данный элемент в избыточном количестве более чем опасен для организма. Имеется в виду отравление галогеном, хроническое или острое. В первом случае организм стабильно получает значительную дозу химического вещества, но для яркой клинической картины этого не достаточно. Поэтому первые признаки могут появиться спустя годы.
Острая форма отравления заявляет о себе немедленно, провоцируя нарушение работы сердечно-сосудистой/дыхательной систем. Жизни пациента угрожает опасность, а здоровью – инвалидность.
Однако не каждый переизбыток йода можно назвать отравлением. Чаще всего патология проявляется как комплекс симптомов:
- Йододерма или поражение кожных покровов
- У больного (область лица, шеи, рук, ног) появляется характерная сыпь, чем-то напоминающая угревую. Отличительным фактором считается сильный дискомфорт, жжение, зуд, а также своеобразное слияние нескольких образований в одно пятно с багровым оттенком.
- Конъюктивит. Слизистые оболочки особенно уязвимы перед галогеном, что проявляется как воспалительные процессы, слезотечения, ухудшения зрения.
- Респираторные заболевания. Спровоцированы раздражением слизистой дыхательных путей.
- Повышенное слюноотделение. Слюнные железы также страдают от повышенной концентрации йода в организме, отекают/воспаляются.
- Дополнительная симптоматика Встречается реже, но, все же, имеет место: металлический привкус во рту, неприятный запах, дискомфорт слизистой горла, сбой работы ЖКТ/мочеполовой системы, снижение иммунитета, сильная слабость, безвольность, токсический гепатит. Часто об избытке йода говорит Базедова болезнь.
Периодическая таблица Менделеева
 Периодическая система была составлена Дмитрием Менделеевым во второй половине 19 века. Открытие не только позволило упростить работу химиков, она смогла объединить в себе как в единой системе все открытые химические вещества, а также предсказать будущие открытия.
Периодическая система была составлена Дмитрием Менделеевым во второй половине 19 века. Открытие не только позволило упростить работу химиков, она смогла объединить в себе как в единой системе все открытые химические вещества, а также предсказать будущие открытия.
Создание данной структурированной системы бесценно для науки и для человечества в целом. Именно это открытие дало толчок развитию всей химии на долгие годы.
В интервью одному журналисту ученый объяснил, что работал над ней 25 лет и то, что она ему снилась – вполне естественно, но это не значит, что во сне пришли все ответы.
Созданная Менделеевым система делится на две части:
- периоды – столбики по горизонтали в одну или две строки (ряды),
- группы – вертикальные строчки, в один ряд.
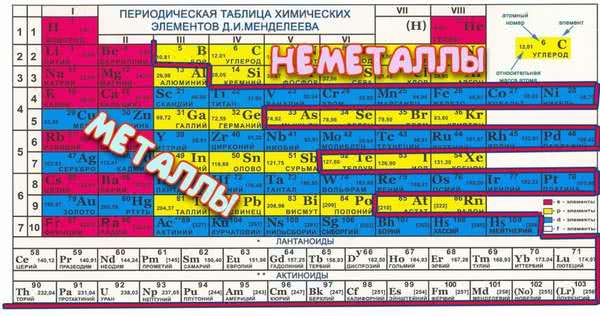
Всего в системе 7 периодов, каждый следующий элемент отличен от предыдущего большим количеством электронов в ядре, т.е. заряд ядра каждого правого показателя больше левого на единицу. Каждый период начинается с металла, а заканчивается инертным газом – именно это и есть периодичность таблицы, ведь свойства соединений меняются внутри одного периода и повторяются в следующем. При этом, следует помнить, что 1-3 периоды неполные или малые, в них всего 2, 8 и 8 представителей. В полном периоде (т.е. оставшихся четырех) по 18 химических представителей.
 В группе располагаются химические соединения с одинаковой высшей валентностью, т.е. у них одинаковое электронное строение. Всего в системе представлено 18 групп (полная версия), каждая из которых начинается щелочью и заканчивается инертным газом. Все, представленные в системе субстанции, можно разделить на две основные группы – металл или неметалл.
В группе располагаются химические соединения с одинаковой высшей валентностью, т.е. у них одинаковое электронное строение. Всего в системе представлено 18 групп (полная версия), каждая из которых начинается щелочью и заканчивается инертным газом. Все, представленные в системе субстанции, можно разделить на две основные группы – металл или неметалл.
Для облегчения поиска группы имеют свое название, а металлические свойства субстанций усиливаются с каждой нижней строчкой, т.е. чем ниже соединение, тем больше у него будет атомных орбит и тем слабее электронные связи. Также меняется и кристаллическая решетка – она становится ярко выраженной у элементов с большим количеством атомных орбит.
В химии используют три вида таблиц:
- Короткая – актиноиды и лантаноиды вынесены за границы основного поля, а 4 и все последующие периоды занимают по 2 строчки.
- Длинная – в ней актиноиды и лантаноиды вынесены за границу основного поля.
- Сверхдлинная – каждый период занимает ровно 1 строку.
https://youtube.com/watch?v=YZvfmcFYe0Q
Главной считается та таблица Менделеева, которая была принята и подтверждена официально, но для удобства чаще используют короткую версию. Металлы и неметаллы в таблице Менделеева располагаются согласно строгим правилам, которые облегчают работу с ней.
Йодное число различных масел и жиров
Йодное число помогает классифицировать масла по степени ненасыщенности на высыхающие масла , имеющие IV> 150 (т. Е. Льняное , тунговое ), полувысыхающие масла IV: 125 — 150 ( соевые бобы , подсолнечник ) и невысыхающие масла с IV <125. ( рапсовый , оливковый , кокосовый ). Интервалы IV для нескольких распространенных масел и жиров представлены в таблице ниже.
| Толстый | Йодное число (г / 100г) |
|---|---|
| Говяжий жир | 42 — 48 |
| Пчелиный воск | 7 — 16 |
| Масло сливочное | 25 — 42 |
| Рапсовое масло | 110 — 126 |
| касторка | 81 — 91 |
| Кокосовое масло | 32 — 40 |
| Кокосовое масло | 6 — 11 |
| Масло печени трески | 148 — 183 |
| Кукурузное масло | 107 — 128 |
| Хлопковое масло | 100 — 115 |
| Рыбий жир | 190 — 205 |
| Масло виноградных косточек | 94 — 157 |
| Масло лесного ореха | 83 — 90 |
| Масло жожоба | 80 — 85 |
| Масло семян капока | 86 — 110 |
| Сало | 52 — 68 |
| Льняное масло | 170 — 204 |
| Оливковое масло | 75 — 94 |
| Oiticica масло | 139 — 185 |
| Пальмоядровое масло | 14 — 21 |
| пальмовое масло | 49 — 55 |
| Арахисовое масло | 82 — 107 |
| Пекановое масло | 77 — 106 |
| Фисташковое масло | 86 — 98 |
| Маковое масло | 140 — 158 |
| Рапсовое масло | 94 — 120 |
| Масло из рисовых отрубей | 99 — 108 |
| Сафлоровое масло | 135 — 150 |
| Кунжутное масло | 100 — 120 |
| Подсолнечное масло | 110 — 145 |
| Соевое масло | 120 — 139 |
| тунговое масло | 160 — 175 |
| Масло грецкого ореха | 132 — 162 |
| Масло зародышей пшеницы | 115 — 128 |
Почему активность йода меньше, чем у других галогенов
Реакционная способность неметаллов определяется силой притягивания к ядру собственного атома чужих электронов. Чем меньше радиус атома, тем силы электростатического притяжения его отрицательно заряженных частиц других атомов выше. Чем выше номер периода, в котором расположен элемент, тем больше энергетических уровней он будет иметь. Йод находится в пятом периоде, и количество энергетических слоев у него больше, чем у брома, хлора и фтора. Именно поэтому молекула йода содержит атомы, имеющие радиус намного больше, чем у ранее перечисленных галогенов. Вот почему частицы I 2 слабее притягивают электроны, что приводит к ослаблению их неметаллических свойств. Внутреннее строение вещества неизбежно влияет и на его физические характеристики. Приведем конкретные примеры.

Физические и химические свойства йода

Йод – это известный всем химический элемент. Но большинство людей знакомы только с его спиртовым раствором, который применяется в медицине. В последнее время также часто говорят о его недостатке в организме при заболевании щитовидной железы. Редко кому известны физические и химические свойства йода. А это довольно своеобразный элемент, который широко распространен в природе и важен для человеческой жизнедеятельности.
Даже в быту можно использовать химические свойства йода, например, для определения наличия крахмала в продуктах. Кроме того, в последнее время рекламируется много народных методов применения этого микроэлемента для лечения многих заболеваний. Поэтому каждому нужно знать, какими свойствами он обладает.
Особенности электронной формулы
Пять энергетических уровней и почти полностью заполненный электронами последний из них подтверждают наличие у элемента ярко выраженных признаков неметаллов. Как и другие галогены, йод является сильным окислителем, забирая у металлов и более слабых неметаллических элементов — серы, углерода, азота — недостающий до завершения пятого уровня электрон.
Йод – неметалл, в молекулах которого присутствует общая пара p-электронов, связывающая атомы между собой. Их плотность в месте перекрывания наибольшая, общее электронное облако не смещается ни к одному из атомов и располагается в центре молекулы. Формируется неполярная ковалентная связь, а сама молекула имеет линейную форму. В ряду галогенов, от фтора до астата, прочность ковалентной связи уменьшается. Наблюдается уменьшение величины энтальпии, от которой зависит распад молекул элемента на атомы. Какие же последствия для химических свойств йода это имеет?
Метаболизм
Всасывание иода происходит в верхних отделах тонкого кишечника, куда он поступает в виде органических и неорганических соединений – йодидов, йодированных аминокислот, и жирных кислот. Большая часть всосавшегося йода связывается со специфическим белком-переносчиком, и в таком виде разносится по органам и тканям.
При этом он поступает в печень, в почки, в яичники у женщин, и в предстательную железу у мужчин. Определенное количество микроэлемента поглощается кожей и ее придатками, волосами и ногтями.
Но основным потребителем I является, конечно же, щитовидная железа. Функциональная ткань этой железы состоит из множества мельчайших пузырьков, фолликулов. Фолликулы изнутри выстланы клетками-тиреоцитами, и заполнены коллоидом. Эта вязкая субстанция содержит белки-тиреоглобулины, которые поступают сюда из тиреоцитов.
В образовании тиреоглобулинов участвует аминокислота L -тирозин. Тиреоглобулины – это сырье для образования трийодтиронина и тироксина.
Йод вначале поступает из крови в тиреоциты, а затем – в коллоид. Здесь при участии железа и специфического фермента тиреоидной пероксидазы происходит последовательное йодирование, присоединение атомов I к молекуле тиреоглобулина.
Присоединяется 1 молекула – образуется монойодтиронин, 2 – дийодтиронин. Правда, эти вещества не активны. Но с дальнейшим присоединением йода образуются трийодтиронин или Т3, и тироксин или Т4.
Эти вещества уже обладают гормональной активностью. Правда эта активность, как и их содержание, неодинакова. Содержание Т4 в несколько раз больше, чем Т3. Зато Т3 более активен, чем Т4. Установлено, что Т3 образуется из Т4 в ходе дейодирования, отщепления молекулы йода. Щитовидные гормоны, тироксин и трийодтиронин, выбрасываются в кровь.
В плазме крови они связываются другим переносчиком, тироксинсвязывающим глобулином, и в таком виде разносятся по органам и тканям. Выполнив свою функцию, они частично разрушаются, а частично выводятся в неизмененном виде. Свободный йод, и йод в составе тиреоидных гормонов, покидает наш организм в основном с мочой, и в меньшей степени – с калом.
Определенное количество I выводится со слюной и с потом. Примечательно, что по выведению йода с мочой (йодурии) можно судить о наличии йода в организме. Чем больше йода поступает в организм, тем больше его выводится с мочой, и наоборот.
Поэтому низкая йодурия свидетельствует о нехватке I. И по той же причине определение йода в моче используют для выявления йододефицитных состояний.
Периодический закон
К середине XIX века учёные располагали множеством сведений о физических и химических свойствах разных элементов и их соединений. Появилась необходимость упорядочить эти знания и представить их в наглядном виде. Исследователи из разных стран пытались создать классификацию, объединяя элементы по сходству состава и свойств веществ, которые они образуют. Однако ни одна из предложенных систем не охватывала все известные элементы.
Пытался решить эту задачу и молодой русский профессор Д.И. Менделеев. Он собирал и классифицировал информацию о свойствах элементов и их соединений, а затем уточнял её в ходе многочисленных экспериментов. Собрав данные, Дмитрий Иванович записал сведения о каждом элементе на карточки, раскладывал их на столе и многократно перемещал, пытаясь выстроить логическую систему. Долгие научные изыскания привели его к выводу, что свойства элементов и их соединений изменяются с возрастанием атомной массы, однако не монотонно, а периодически.
Так был открыт периодический закон, который учёный сформулировал следующим образом: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».
Своё открытие Менделеев совершил почти за 30 лет до того, как учёным удалось понять структуру атома. Открытия в области атомной физики позволили установить, что свойства элементов определяются не атомной массой, а зависят от количества электронов, содержащихся в нём. Поэтому современная формулировка закона звучит так:
Свойства химических элементов, а также формы и свойства образуемых ими веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов.
Этот принцип Менделеев проиллюстрировал в таблице, в которой были представлены все 63 известных на тот момент химических элемента. При её создании учёный предпринял ряд весьма смелых шагов.
<<Форма демодоступа>>
Во-первых, многочисленные эксперименты позволили Менделееву сделать вывод, что атомные массы некоторых элементов ранее были вычислены неправильно, и он изменил их в соответствии со своей системой.
Во-вторых, в таблице были оставлены места для новых элементов, открытие которых учёный предсказал, подробно описав их свойства.
Первый вариант Периодической таблицы элементов, составленной Д.И. Менделеевым.
Мировое научное сообщество поначалу скептически отнеслось к открытию русского химика. Однако вскоре были открыты предсказанные им химические элементы: галлий, скандий и германий. Это разрушило сомнения в правильности системы Менделеева, которая навсегда изменила науку. Там, где раньше учёному требовалось провести ряд сложнейших (и даже не всегда возможных в реальности) опытов — теперь стало достаточно одного взгляда в таблицу.
Теперь расскажем, как устроена Периодическая таблица элементов Менделеева и как ею пользоваться.
Йод (I, Iodum)
История йода
Открытие йода датируется 1811 годом, элемент был открыт французом Бернаром Куртуа, который в своё время был специалистом по мыло- и селитроварению. Однажды, при опытах с золой морских водорослей, химик заметил, что медный котёл для выпаривания золы подвержен быстрому разрушению. При смешивании зольных паров с серной кислотой образовывались пары насыщенного фиолетового цвета, которые при осаживании превращались в блестящие кристаллы тёмного «бензинового» цвета. Спустя два года Жозеф Гей-Люссак и Хэмфри Дэви занялись изучением полученного вещества и назвали его йодом (от греческого iodes, ioeides –фиолетовый, фиалковый).

Общая характеристика йода
Йод – галоген, относится к химически активным неметаллам, элемент 17-й группы V периода периодической таблицы химических элементов Д.И. Менделеева, имеет атомный номер 53, принятое обозначение I (Iodum).
Нахождение в природе
Йод является достаточно редким элементом, но, как ни странно, в природе присутствует практически везде, в любом живом организме, в морской воде, почве, продуктах растительного и животного происхождения. Традиционно самое большое количество натурального йода поставляют морские водоросли.
Физические и химические свойства
Йод представляет собой твёрдое вещество, в виде кристаллов тёмно-фиолетового или чёрно-серого цвета, имеет металлический блеск и специфический запах. Пары йода – фиолетовые, образуются при нагревании микроэлемента, а при его охлаждении превращаются в кристаллы, не становясь жидкими. Для получения жидкого йода его нужно нагреть под давлением.
Суточная потребность в йоде
Для нормального функционирования щитовидной железы взрослому человеку необходимо 150-200 мкг йода, подросткам, беременным женщинам и кормящим мамочкам необходимо увеличить количество йода, поступающего в организм ежедневно до 400 мкг в сутки.
Продукты питания богатые йодом
Основные источники йода:
- морепродукты: морская капуста, рыба, рыбий жир, мидии, креветки;
- овощи: свекла, салат, шпинат, помидоры, морковь, картофель, лук репчатый, фасоль, чеснок;
- фрукты, ягоды, орехи: хурма, яблоки, виноград, вишня, слива, абрикосы, фейхоа, земляника, грецкие и кедровые орехи;
- крупы: гречневая, пшено;
- молочные продукты: сыр, творог, молоко.
Нужно помнить, что при кулинарной обработке теряется до половины количества йода, так же, как и при длительном хранении.

Полезные свойства йода и его влияние на организм
Йод – активный участник окислительных процессов, которые напрямую влияют на стимулирование мозговой деятельности. Большая часть йода в организме человека сосредоточена в щитовидной железе и плазме. Йод способствует нейтрализации нестойких микробов, тем самым уменьшая раздражительность и стрессы (calorizator). Также йод имеет свойство повышать эластичность стенок сосудов.
Йод облегчит соблюдение диеты, сжигая избыточный жир, способствует правильному росту, придает больше энергии, улучшает умственную активность, делает волосы, ногти, кожу и зубы здоровыми.
Признаки нехватки йода
Нехватка йода как правило наблюдается в регионах, где недостаточно натурального микроэлементами. Признаками йододефицита называют повышенную утомляемость и общую слабость, частые головные боли, увеличение массы тела, заметные ослабления памяти, а также зрения и слуха, конъюнктивиты, сухость слизистых оболочек и кожных покровов. Недостаток йода приводит к нарушению менструального цикла у женщин и снижению полового влечения и активности мужского пола.
Признаки избытка йода
Избыток йода вреден не меньше, чем его недостаток. Йод – токсичный микроэлемент, при работе с ним нужно быть крайне осторожным, чтобы избежать отравления, которое характеризуется сильными болями в желудками, рвотой и поносом. При переизбытке йода в воде отмечаются следующие симптомы: аллергическая сыпь и ринит, повышение потливости с резким запахом, бессонница, повышенное слюноотделение и отёки слизистых, дрожь, учащённое сердцебиение. Самое распространённое заболевание, связанное с увеличенным количеством йода в организме – базедова болезнь.

Нахождение в природе
Иод.
Иод — редкий элемент. Его кларк — всего 0,5 мг/кг. Однако он чрезвычайно сильно рассеян в природе и, будучи далеко не самым распространённым элементом, присутствует практически везде. Иод находится в виде иодидов в морской воде (20—30 мг на тонну морской воды). Присутствует в живых организмах, больше всего в водорослях (до 3 г на тонну высушенной морской капусты — водоросли ламинарии). Известен в природе также в свободной форме, в качестве минерала, но такие находки единичны, — в термальных источниках Везувия и на острове Вулькано (Италия). Запасы природных иодидов оцениваются в 15 млн тонн, 99 % запасов находятся в Чили и Японии. В настоящее время в этих странах ведётся интенсивная добыча иода, например, чилийская Atacama Minerals производит свыше 720 тонн иода в год. Наиболее известный из минералов иода — лаутарит Ca(IO3)2. Некоторые другие минералы иода — иодобромит Ag(Br, Cl, I), эмболит Ag(Cl, Br), майерсит CuI·4AgI.
Сырьём для промышленного получения иода в России служат нефтяные буровые воды, тогда как в зарубежных странах, не обладающих нефтяными месторождениями, используются морские водоросли, а также маточные растворы чилийской (натриевой) селитры, щёлок калийных и селитряных производств, что намного удорожает производство иода из такого сырья.
Типичная концентрация иода в подземных рассолах (где он существует обычно в форме иодида натрия) составляет 30…150 ppm. Оцененные запасы иода в рассолах составляют 5 млн тонн в Японии, 0,25 млн тонн в США, 0,1 млн тонн в Индонезии и 0,36 млн тонн суммарно в Туркменистане, Азербайджане и России. Запасы иода в чилийских залежах каличе (известковых вторичных отложений с примесями нитратов, хлоридов, иодатов и других растворимых солей в пустыне Атакама, где он присутствует в виде иодата кальция Ca(IO3)2) составляют 1,8 млн тонн. Кроме того, отмечается возможность добычи иода из морских водорослей (запасы около 4 тыс. тонн в Японии). Суммарная оценка запасов иода составляет 7,5 млн тонн, не считая морской воды (34,5 млн тонн), прямая добыча иода из которой экономически невыгодна ввиду низкой концентрации — менее 0,05 ppm.
Применение
В медицине
5%-й спиртовой раствор иода
5-процентный спиртовой раствор иода используется для дезинфекции кожи вокруг повреждения (рваной, резаной или иной раны), но не для приёма внутрь при дефиците иода в организме. Продукты присоединения иода к крахмалу (т. н. «Синий йод» — Йодинол, Йокс, Бетадин и др.) являются более мягкими антисептиками.
При большом количестве внутримышечных инъекций на их месте пациенту делается йодная сетка — йодом рисуется сетка на площади, в которую делаются инъекции (например, на ягодицах). Это нужно для того, чтобы быстро рассасывались «шишки», образовавшиеся в местах внутримышечных инъекций.
В рентгенологических и томографических исследованиях широко применяются йодсодержащие контрастные препараты.
Иод-131, как и некоторые радиоактивные изотопы иода (125I, 132I), применяется в медицине для диагностики и лечения заболеваний щитовидной железы. Изотоп широко применяется при лечении диффузно-токсического зоба (болезни Грейвса), некоторых опухолей. Согласно нормам радиационной безопасности НРБ-99/2009, принятым в России, выписка из клиники пациента, лечившегося с использованием иода-131, разрешается при снижении общей активности этого нуклида в теле пациента до уровня 0,4 ГБк.
В криминалистике
В криминалистике пары иода применяются для обнаружения отпечатков пальцев на бумажных поверхностях, например на купюрах.
В технике: рафинирование металлов
Источники света
Иод используется в источниках света:
- галогеновых лампах — в качестве компонента газового наполнителя колбы для осаждения испарившегося вольфрама нити накаливания обратно на неё.
- металлогалогеновых дуговых лампах — в качестве газовой среды разряда используются галогениды ряда металлов, использование различных смесей которых позволяет получать лампы с большим разнообразием спектральных характеристик.
Производство аккумуляторов
Иод используется в качестве компонента положительного электрода (окислителя) в литиево-ионных аккумуляторах для автомобилей.
Лазерный термоядерный синтез
Некоторые иодорганические соединения применяются для производства сверхмощных газовых лазеров на возбуждённых атомах иода (исследования в области лазерного термоядерного синтеза).
Динамика производства и потребления иода
Мировое потребление иода в 2016 году составило ок. 33 тыс. тонн. Около 18 % (6 тыс. тонн) поступает от вторичной переработки. Более 95 % от мирового производства иода добывается в 6 странах: Япония, США, Туркменистан, Азербайджан, Индонезия (во всех перечисленных — из подземных рассолов) и Чили (из природных залежей иодатов в Атакаме). Большинство иода США добывается из рассолов, откачиваемых из глубоких скважин в северной Оклахоме. В Японии иод добывается как побочный продукт из иодоносных рассолов газовых скважин. В Азербайджане и Туркменистане добыча рассолов осуществляется из специально пробуренных скважин, не ассоциированных с добычей нефти или газа. В Индонезии месторождения иодоносных рассолов эксплуатируются в Моджокерто (Восточная Ява), производство идёт главным образом на внутреннее потребление.
Около 3 % мирового производства иода идёт для пищевых потребностей человека как микроэлемент (добавка в поваренную соль и отдельные пищевые добавки). Около 8 % расходуется на пищевые добавки для животных. 22 % идёт на производство рентгеноконтрастных веществ, используемых в медицинской диагностике, 13 % на другие фармпрепараты, 7 % на дезинфектанты (такие как иодная настойка), 4% на биоциды, добавляемые в краски для подавления роста плесневых грибков на окрашиваемой поверхности. 12 % иода используется для производства поляризационных плёнок жидкокристаллических дисплеев (в форме полииодидов I−3 и I−5). 4% расходуется в форме иодида меди(I) и других иодидов в качестве добавок к полиамидам (капрон, нейлон и др.) для их стабилизации по отношению к воздействию тепла, света и кислорода.
Физические свойства
Из всех микроэлементов йод считается самым противоречивым. Большинство людей не знают о его особенностях. Физические и химические свойства йода кратко изучаются в школе. В основном распространен этот элемент в виде изотопа с массой 127. Это самый тяжелый из всех галогенов. Есть еще радиоактивный йод 125, который получается при распаде урана. В медицине же чаще применяются искусственные изотопы этого элемента с массой 131 и 133.
Из всех галогенов йод единственный, который в естественном состоянии твердый. Он может быть представлен темно-фиолетовыми или черными кристаллами или пластинками с металлическим блеском. Они имеют слабый характерный запах, хорошо проводят электрический ток и немного похожи на графит. В таком состоянии этот микроэлемент плохо растворяется в воде, но очень легко переходит в газообразное состояние. Он может превратиться в фиолетовый пар уже при комнатной температуре. Эти физико-химические свойства йода используются для его получения. Нагревая микроэлемент под давлением, а потом охлаждая, его очищают от примесей. Растворяют йод в спирте, глицерине, бензоле, хлороформе или сероуглеродах, получая бурые или фиолетовые жидкости.







